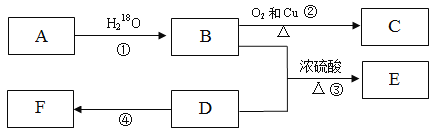
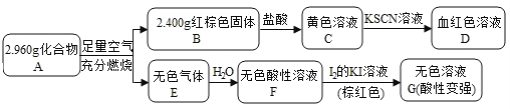
-
结合乙烯和乙醇的结构与性质,推测丙烯醇(CH2=CH—CH2OH)不能发生的化学反应( )
A.加成反应
B.氧化反应
C.与Na反应
D.与Na2CO3溶液反应放出CO2
难度: 简单查看答案及解析
-
下列有机物中,能以任意比与水互溶的是
A.乙酸乙酯 B.乙醇 C.氯仿 D.溴苯
难度: 简单查看答案及解析
-
学习化学的工具离不开化学用语,下列化学用语正确的是
A.乙烯的最简式为 C2H4 B.硝基苯的结构简式为
C.乙醇的官能团为 OH- D.乙酸的分子式为 C2H4O2
难度: 简单查看答案及解析
-
2020年春季抗击新冠肺炎中N95口罩成为“明星”,丙烯是制造N95口罩的原料。下列有关丙烯的说法错误的是( )
A.丙烯和乙烯互为同系物
B.丙烯能使酸性高锰酸钾溶液褪色
C.丙烯分子中碳原子在一条直线上
D.丙烯与氢气的加成产物是饱和烃
难度: 简单查看答案及解析
-
下列化学式只能表示一种物质的是
A.C3H8 B.C4H10 C.C6H12O6 D.C12H22O11
难度: 中等查看答案及解析
-
下列反应中,生成物所储存的化学能比反应物所储存的化学能多的是
A.2Na2O2 + 2H2O = 4NaOH + O2↑
B.NaOH + HCl = NaCl + H2O
C.CH4 + 2O2
CO2 + 2H2O
D.Ba(OH)2·8H2O + 2NH4Cl = BaCl2 + 2NH3↑ + 10H2O
难度: 简单查看答案及解析
-
关于化学键与化合物的叙述中,不正确的是
A.离子化合物中一定含有金属离子 B.共价化合物一定不含离子键
C.氯化钙含有离子键,不含共价键 D.离子化合物中可能含共价键
难度: 简单查看答案及解析
-
下列说法不正确的是
A.棉花、花生油、蛋白质不全属于高分子化合物
B.淀粉和纤维素均为多糖,二者不互为同分异构体
C.将蔗糖溶于水,加入几滴稀硫酸并加热几分钟后,再加入银氨溶液不能析出银
D.油脂在酸或碱催化下均可以水解,油脂的水解反应称为皂化反应
难度: 中等查看答案及解析
-
下列变化中既有离子键断裂,又有共价键断裂的是
A.NH4Cl受热 B.HCl溶于水 C.冰雪融化 D.NaCl溶于水
难度: 简单查看答案及解析
-
下列各组粒子的性质比较不正确的是
A.氢化物沸点:HF<HCl<HBr<HI B.酸性:HClO4>H2SO4>H3PO4
C.元素的非金属性:Si<S<O<F D.离子半径:O2->F->Na+>Mg2+
难度: 中等查看答案及解析
-
下列说法中,不正确的的是
A.能源与材料、信息一起被称为现代社会发展的三大支柱
B.乙烯是一种植物生长调节剂,也是水果催熟剂,其产量可衡量国家石油化工水平
C.德国化学家凯库勒从梦境中得到启发,提出了关于苯环结构的重要学说
D.乙醇能与活泼金属钠反应,不能被酸性 K2Cr2O7溶液直接氧化成乙酸
难度: 中等查看答案及解析
-
下列有关说法不正确的是
A.随着原子序数的递增,碱金属元素单质的密度依次增大、熔点降低
B.光照下甲烷和氯气混合能发生取代反应,生成的有机物属于烃的衍生物
C.含 2n 个氢原子的烷烃分子中,所含有的化学键都是单键,且为(3n-2)个
D.水结成冰,体积膨胀,密度变小的原因与氢键有关
难度: 中等查看答案及解析
-
下列关于有机物的说法正确的是
A.具有同一通式的物质一定互为同系物,如 C2H6和 C4H10
B.糖类、油脂和蛋白质都只含有C、H、O 三种元素,分子结构比较复杂
C.苯与浓硝酸、浓硫酸混合共热制取硝基苯,属于取代反应
D.1mol C2H4 与 Cl2 完全加成,再与 Cl2 彻底取代,两过程共消耗 3molCl2
难度: 中等查看答案及解析
-
初步提纯下列物质,(括号内为杂质),选用的试剂和分离方法均正确的是
序号
物质
试剂
分离方法
①
乙酸乙酯(乙酸)
NaOH溶液
分液
②
溴苯(溴)
NaOH溶液
分液
③
乙醇(水)
生石灰
蒸馏
④
苯(环已烷)
水
分液
A.①② B.①③ C.②③ D.④③
难度: 中等查看答案及解析
-
用 NA 表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,28g乙烯含有的共用电子对数为6NA
B.标准状况下,11.2L庚烷中含有的分子数为0.5NA
C.常温常压下,78g苯完全燃烧时断裂碳碳双键数为3NA
D.1 mol-CH3(甲基)含有的电子数为10NA
难度: 简单查看答案及解析
-
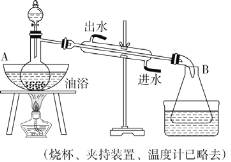
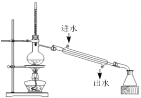
下列实验装置设计正确,且能达到目的的是
A.
 石油的分馏 B.
石油的分馏 B.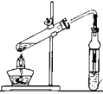 制备乙酸乙酯
制备乙酸乙酯C.
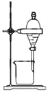 分离乙酸和乙醇 D.
分离乙酸和乙醇 D.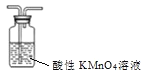 除甲烷中的乙烯
除甲烷中的乙烯难度: 简单查看答案及解析
-
国际无机化学命名委员会在 1989 年做出决定,把现行元素周期表原先的主、副族及族号取消,由左至右改为 18 列。如碱金属元素为第 1 列,稀有气体元素为第 18 列。按此规定,下列说法不正确的是
A.第 3 列元素种类最多
B.第 14 列元素形成的化合物种类最多
C.只有第 2 列元素的原子最外层有 2 个电子
D.第 17 列元素都是非金属元素,从上到下,单质的氧化性逐渐减弱
难度: 中等查看答案及解析
-
在 25 mL 1.00 mol/L HCl 溶液中逐滴加入未知浓度 NaOH 溶液 V mL,将溶液搅拌均匀后,在保温隔热的条件下测量并记录混合溶液的温度,实验结果如图所示。下列叙述正确的是
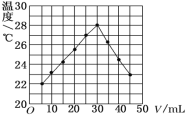
A.做该实验时环境温度为22℃
B.加入30 mLNaOH 溶液时,HCl完全被中和
C.NaOH 溶液的物质的量浓度约为1.0 mol/L
D.该实验表明热能可能转化为化学能
难度: 中等查看答案及解析
-
恒温下,物质的量之比为2∶1的SO2和O2的混合气体在容积为2 L的恒容密闭容器中发生反应:2SO2(g)+O2(g)
2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
时间/min
0
1
2
3
4
5
n(SO2)/mol
0.20
0.16
0.13
0.11
0.08
0.08
下列说法正确的是( )
A. 当容器中气体的密度不变时,该反应达到平衡状态
B. 该反应进行到第3分钟时,逆反应速率小于正反应速率
C. 从反应开始到达到平衡,用SO3表示的平均反应速率为0.01 mol/(L·min)
D. 容器内达到平衡状态时的压强与起始时的压强之比为5∶4
难度: 困难查看答案及解析
-
分子式为 C4H8BrCl 的有机物(不含立体结构)共有
A.9 种 B.10 种 C.11 种 D.12 种
难度: 中等查看答案及解析
-
已知三种有机物
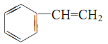 (x)
(x) (y)
(z),下列说法不正确的是
A.x、y、z 互为同分异构体,z 的二氯代物有三种
B.x、y 的一氯代物均只有三种,z 的一氯代物有一种
C.x、y 可使溴的四氯化碳溶液因发生加成反应而褪色
D.x、y、z 中只有 x 的所有原子可能处于同一平面
难度: 中等查看答案及解析
-
已知四种短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与 X、Y、Z 原子的核外内层电子数相同。X 的一种核素在考古时常用来鉴定一些文物的年代,工业上采用分离液态空气的方法来生产Y的单质,而Z不能形成双原子分子。根据上述叙述,下列说法中正确的是
A.四种元素的原子半径大小为 W﹤X﹤Y﹤Z
B.W、X、Y、Z 原子的核外最外层电子数的总和为20
C.W 与 Y 可形成既含极性共价键又含非极性共价键的化合物
D.由 W 与 X 组成的化合物的沸点一定低于由 W 与 Y 组成的化合物的沸点
难度: 中等查看答案及解析
-
某原电池装置如图所示,电池总反应为 2Ag + Cl2 = 2AgCl。已知阳离子交换膜只允许阳离子通过,阴离子不能通过,离子交换过程中溶液电荷守恒。下列说法正确的是
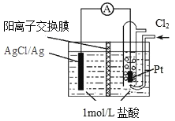
A.正极反应式为 AgCl + e—= Ag + Cl—
B.放电时,交换膜右侧溶液中有大量白色沉淀生成
C.若用 NaCl 溶液代替盐酸,则电池总反应随之改变
D.当外电路中转移 0.1mol e—时,阳离子交换膜左侧溶液中约减少0.2mol 离子
难度: 中等查看答案及解析
-
元素X、Y和Z可结合形成化合物XYZ3;X、Y和Z的原子序数之和为26;Y和Z在同一周期,下列有关推测正确的是
A.XYZ3是一种可溶于水的酸,且X与Y可形成共价化合物XY
B.XYZ3是一种易溶于水的盐,且Y 与Z可形成离子化合物YZ
C.XYZ3是一种微溶于水的盐,且X 与Z可形成离子化合物XZ
D.XYZ3是一种离子化合物,且Y 与Z可形成离子化合物YZ3
难度: 中等查看答案及解析
-
根据原电池原理,有人利用CH4和O2的反应,在KOH溶液中用铂作电极设计出燃料电池。关于该燃料电池的下列几种说法中正确的是
①理论上每消耗标准状况下22.4L的CH4,可以向外电路提供8mole-
②负极上是O2获得电子,电极反应式为O2+4e-+2H2O=4OH-
③外电路电子由负极流向正极,内电路电子由正极流向负极
④电池放电过程中,溶液的pH不断降低
⑤负极发生氧化反应,正极发生还原反应
⑥负极会出现淡蓝色火焰
⑦电解质溶液中 OH-向负极移动,K+向正极移动
⑧该电池的总反应为CH4+2O2=CO2+2H2O
A.①④⑤⑦ B.①③④⑧ C.②③⑥⑧ D.②⑤⑦⑧
难度: 中等查看答案及解析