-
短周期主族元素X、Y、Z、W的原子序数依次增大,X是地壳中含量最多的元素,Y原子的最外层有2个电子,Z的单质晶体是应用最广泛的半导体材料,W与X位于同一主族。下列说法正确的是
A.原子半径:r(W)> r(Z)> r(Y)> r(X)
B.由X、Y组成的化合物是离子化合物
C.Z的最高价氧化物对应水化物的酸性比W的强
D.W的简单气态氢化物的热稳定性比X的强
难度: 简单查看答案及解析
-
下列表示不正确的是
A.KOH的电子式:
B.二氧化碳的结构式:O=C=O
C.CH4的球棍模型:

D.S2ˉ的离子结构示意图:
难度: 简单查看答案及解析
-
对可逆反应4NH3(g)+5O2(g)
4NO(g)+6H2O(g),下列叙述正确的是
A.达到化学平衡时,4v正(O2) = 5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3) = 3v正(H2O)
难度: 中等查看答案及解析
-
肼(H2N—NH2)是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂1 mol化学键所需的能量(kJ):N≡N键为942、O=O键为500、N—N键为154,则断裂1 mol N—H键所需的能量(kJ)是( )

A. 194 B. 391 C. 516 D. 658
难度: 简单查看答案及解析
-
可逆反应:2A(g) + 3B(g)
2C(g)+D(g),在四种不同条件下的反应速率分别为:
①υ(A)=0.5mol·L-1·min-1 ②υ(B)=0.6 mol·L-1·min-1
③υ©=0.35 mol·L-1·min-1 ④υ(D)=0.4 mol·L-1·min-1
该反应在这四种不同条件下反应速率由快到慢的顺序是
A.①②③④ B.②①④③ C.④①②③ D.②④①③
难度: 中等查看答案及解析
-
某烷烃的一种同分异构体只能生成一种一氯代物,则该烃的分子式不可能是
A.C2H6 B.C4H10 C.C5H12 D.C8H18
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.正丁烷的沸点比异丁烷的高,乙醇的沸点比二甲醚的高
B.甲烷、苯、乙醇均不能使溴水或酸性高锰酸钾溶液褪色
C.羊毛、蚕丝、塑料、合成橡胶都属于有机高分子材料
D.天然植物油没有恒定的熔、沸点,常温下难溶于水
难度: 中等查看答案及解析
-
为提纯下列物质(括号内为杂质),所用的除杂试剂和分离方法都正确的是( )
序号
不纯物
除杂试剂
分离方法
A
CH4(C2H4)
酸性KMnO4溶液
洗气
B
苯(Br2)
NaOH溶液
过滤
C
乙酸乙酯(乙酸)
饱和Na2CO3溶液
蒸馏
D
C2H5OH(H2O)
新制生石灰
蒸馏
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
25℃时某气态烃与O2混合充入密闭容器中,点燃后又恢复至25℃,此时容器内压强为原来的
,再经NaOH溶液处理,容器内几乎成为真空,该烃的化学式为( )
A.CH4 B.C2H6 C.C3H8 D.C4H10
难度: 中等查看答案及解析
-
100 mL 6 mol·L-1 H2SO4跟过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量( )
A.碳酸钠(固体) B.少量硫酸铜溶液
C.NaCl溶液 D.加热
难度: 简单查看答案及解析
-
今有如下三个热化学方程式:
2H2(g)+O2(g)=2H2O(g) 放热Q1kJ
2H2(g)+O2(g)=2H2O(l) 放热Q2kJ
H2(g)+1/2O2(g)=H2O(g) 放热Q3 kJ ,其中Q1 Q2 Q3 大小关系是( )
A.Q1=Q2=Q3 B.2Q3=Q1<Q2 C.Q3<Q2<Q1 D.Q1<Q2<3Q3
难度: 中等查看答案及解析
-
已知1g火箭燃料肼(N2H4)气体燃烧生成N2和H2O(g)时,放出16.7kJ的热量,则该反应的热化学方程式正确的是
A.N2H4+O2=N2+2H2O△H=-534.4kJ/mol
B.N2H4(g)+ O2(g)=N2(g)+2H2O(g)△H=-16.7kJ/mol
C.N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-534.4kJ/mol
D.N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.4kJ/mol
难度: 简单查看答案及解析
-
将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是
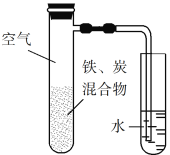
A. 铁被氧化的电极反应式为Fe−3e−
Fe3+
B. 铁腐蚀过程中化学能全部转化为电能
C. 活性炭的存在会加速铁的腐蚀
D. 以水代替NaCl溶液,铁不能发生吸氧腐蚀
难度: 简单查看答案及解析
-
今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是
A.原子半径:W<X
B.常温常压下,Y单质为固态
C.气态氢化物热稳定性:Z<W
D.X的最高价氧化物的水化物是强碱
难度: 中等查看答案及解析
-
下列数据是对应物质的熔点(℃),据此做出的下列判断中错误的是( )
Na2O
NaCl
AlF3
AlCl3
920
801
1 291
190
BCl3
Al2O3
干冰
SiO2
-107
2 073
-57
1 723
A.铝的化合物形成的晶体中有的是离子晶体
B.表中只有BCl3和干冰是分子晶体
C.同族元素的氧化物可形成不同类型的晶体
D.不同族元素的氧化物可形成相同类型的晶体
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.H2(g)+I2(g)⇌2HI(g),其他条件不变,缩小反应容器体积,正逆反应速率不变
B.C(s)+H2O(g)⇌H2(g)+CO(g),碳的质量不再改变说明反应已达平衡
C.若压强不再随时间变化能说明反应2A(?)+B(g)⇌2C(?)已达平衡,则A、C不能同时是气体
D.1 mol N2和3 mol H2反应达到平衡时H2转化率为10%,放出的热量为Q1;在相同温度和压强下,当2 mol NH3分解为N2和H2的转化率为10%时,吸收的热量为Q2,Q2不等于Q1
难度: 中等查看答案及解析
-
如图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加几滴石蕊溶液。下列实验现象中正确的是( )

A.逸出气体的体积,a电极的小于b电极的
B.一电极逸出无味气体,另一电极逸出刺激性气味气体
C.a电极附近呈红色,b电极附近呈蓝色
D.a电极附近呈蓝色,b电极附近呈红色
难度: 简单查看答案及解析
-
为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3D−Zn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3D−Zn—NiOOH二次电池,结构如下图所示。电池反应为Zn(s)+2NiOOH(s)+H2O(l)
ZnO(s)+2Ni(OH)2(s)。以下说法不正确的是

A. 三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
B. 充电时阳极反应为Ni(OH)2(s)+OH−(aq)−e−
NiOOH(s)+H2O(l)
C. 放电时负极反应为Zn(s)+2OH−(aq)−2e−
ZnO(s)+H2O(l)
D. 放电过程中OH−通过隔膜从负极区移向正极区
难度: 困难查看答案及解析
-
下列关于热化学反应的描述中正确的是
A.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的ΔH=+2×283.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
难度: 中等查看答案及解析
 ;③能与水在一定条件下反应生成C
;③能与水在一定条件下反应生成C


