-
化学与社会、生活、生产密切相关。对下列应用的解释错误的是( )
选项
应用
解释
A
液氢可用作长征5号火箭的燃料
液氢是无毒无污染燃料,燃烧热值高
B
高纯硅可用于制作光感电池
硅具有半导体性能,可将太阳能转换为电能
C
二氧化硅可用于制作光导纤维
二氧化硅具有良好导电性能,硬度大
D
钛合金可用于制作飞机的结构部件
钛合金质轻、强度高、耐腐蚀
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
降冰片烯(
)在一定的条件下可以转化为降冰片烷(
)。下列说法正确的是( )
A.降冰片烯不能使酸性高锰酸钾溶液褪色
B.降冰片烷易溶于水
C.降冰片烷与
互为同分异构体
D.降冰片烷的一氯代物有3种(不含立体异构)
难度: 中等查看答案及解析
-
实验室探究SO2性质的装置如图所示。下列说法错误的是( )
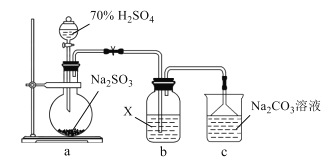
A.装置a中的反应可用铜片和浓硫酸代替
B.若X为H2S溶液,装置b中产生淡黄色沉淀
C.若X为含HCl、BaCl2的FeCl3溶液,装置b中产生白色沉淀
D.反应后装置c中溶液的pH降低
难度: 中等查看答案及解析
-
NA是阿伏加德罗常数的值。下列说法正确的是( )
A.1molK2Cr2O7被还原为Cr3+转移的电子数为3NA
B.0.1molCH4与Cl2在光照下反应生成的CH3Cl分子数为0.1NA
C.常温常压下,124gP4中所含P-P键数目4NA
D.标准状况下,22.4L丙烷中所含共价键数目为10NA
难度: 中等查看答案及解析
-
一种化合物Y2ZW3X可用作牙膏的添加剂,W、X、Y、Z为原子序数依次增大的短周期主族元素,其中Z的最高价氧化物的水化物是三元酸,Y的原子半径是短周期主族元素中最大的,W与X的最外层电子数之和为13。下列说法错误的是( )
A.简单氢化物的沸点:W>X
B.离子半径:Y>W>X
C.Z的最高价氧化物可用作干燥剂
D.Y与X形成的化合物的水溶液呈碱性
难度: 中等查看答案及解析
-
我国科学家研发了一种水系可逆Zn-CO2电池,将两组阴离子、阳离子复合膜反向放置分隔两室电解液,充电、放电时,复合膜层间的H2O解离成H+和OH-,工作原理如图所示。下列说法错误的是( )

A.a膜是阳离子膜,b膜是阴离子膜
B.放电时负极的电极反应式为Zn+4OH--2e-=Zn(OH)42-
C.充电时CO2在多孔Pd纳米片表面转化为甲酸
D.外电路中每通过1mol电子,复合膜层间有1mol H2O解离
难度: 中等查看答案及解析
-
已知Ka(CH3COOH)=1.7×10-5,Kb(NH3·H2O)=1.7×10-5。常温下,用0.01mol·L-1氨水滴定20mL浓度均为0.01mol·L-1的HCl和CH3COOH混合溶液,相对导电能力随加入氨水体积变化曲线如图所示。下列叙述错误的是( )
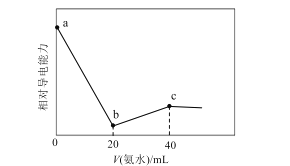
A.a点的混合溶液中c(CH3COO-)约为1.7×10-5mol·L-1
B.b点的混合溶液中:c(CH3COOH)>c(NH4+)
C.c点的混合溶液中:c(NH4+)+c(NH3·H2O)=c(Cl-)+c(CH3COO-)+c(CH3COOH)
D.混合溶液pH=7时,加入氨水体积大于40mL
难度: 中等查看答案及解析
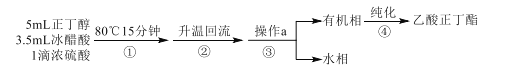

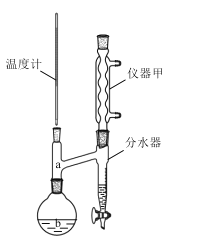
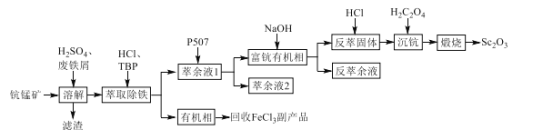
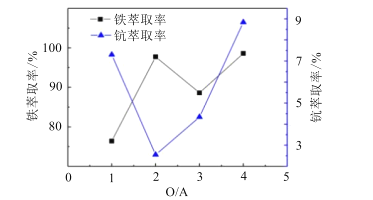
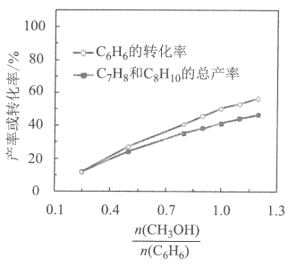
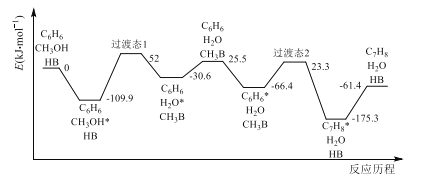
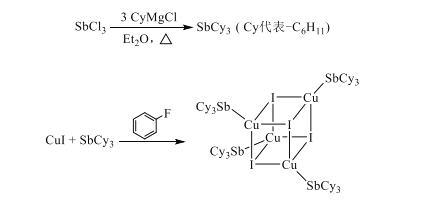
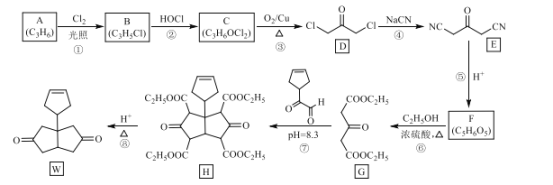
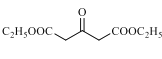 制备
制备