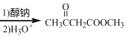-
化学与人类社会的生产、生活有着密切联系,下列叙述不正确的是( )
A.汉代烧制出“明如镜、声如馨”的瓷器,其主要生产原料为黏土
B.东晋《洛神赋图》中的颜料铜绿,主要成分属于盐类
C.宋代《莲塘乳鸭图》所用宣纸,其主要成分是纤维素
D.“华为麒麟980”手机中芯片的主要成分是二氧化硅
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.18g氨基(-ND2)中含有的电子数为10NA
B.56gFe与1molCl2充分反应后转移电子的数目为3NA
C.向密闭容器中加入2molNO和1molO2,充分反应后容器中产物分子的数目为2NA
D.向100mL0.1mol/LNH4Cl溶液中通入NH3至溶液为中性,其中NH4+的数目为0.01NA
难度: 中等查看答案及解析
-
W、X、Y、Z均为短周期元素且原子序数依次增大。Y是短周期中原子半径最大的元素;元素X和Z同族,Z的最高价氧化物对应的水化物的浓溶液与W的单质加热反应,生成两种均能使澄清石灰水变浑浊的无色气体。下列说法正确的是( )
A.工业上常用电解的方法冶炼Y的单质
B.原子半径大小为W<X<Z
C.X、Y形成的化合物只含离子键
D.W、X、Z对应的氢化物中,沸点最高的是X
难度: 中等查看答案及解析
-
有机物M的结构结构简式如图所示。关于M,下列说法正确的是( )
A.分子中所有碳原子可能共平面
B.M的同分异构体中,能与饱和NaHCO3溶液反应有9种
C.可使酸性高锰酸钾溶液褪色
D.1molM与足量的钠反应可以生成22.4LH2
难度: 困难查看答案及解析
-
根据下列实验事实,能得到相应结论的是( )
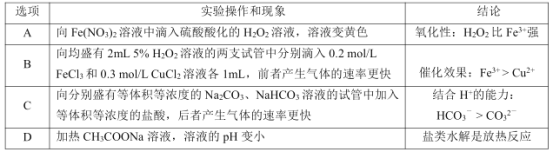
A.A B.B C.C D.D
难度: 困难查看答案及解析
-
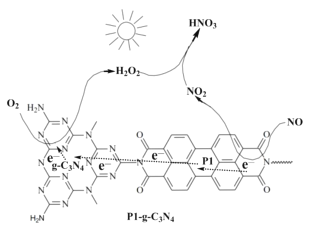
光电池在光照条件下可产生电流,如图装置可以实现光能源的充分利用,双极性膜可将水解离为H+和OH-,并实现其定向通过。下列说法不正确的是( )
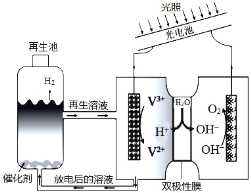
A.该装置可利用光能实现水的分解
B.光照过程中阴、阳极区溶液中的pH均基本不变
C.再生池中的反应为2V2++2H+
2V3++H2↑
D.每有1molOH-通过双极性膜,可产生5.6L(标准状况)的O2
难度: 困难查看答案及解析
-
某温度下,向0.10mol/L的HCOONH4溶液中通入HCl或加入NaOH固体调节溶液pH(忽略溶液体积变化),部分粒子的浓度随pH的变化关系如图所示。其中[NH3]表示溶液中NH3与NH3·H2O的浓度之和,M点的坐标为(6.5,-4)。下列说法不正确的是
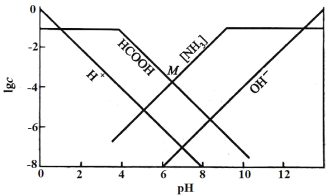
A.此温度下,Kw=1.0×10-14
B.pH<12时,溶液中[NH3]>c(OH-)
C.M点有c(HCOO-)>c(HCOOH)>c(NH4+)>c(H+)>c(OH-)
D.Ka(HCOOH)的数量级为10-4
难度: 困难查看答案及解析
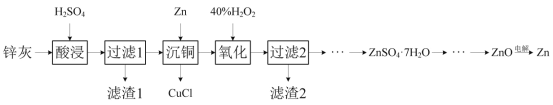
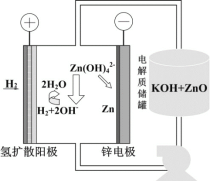
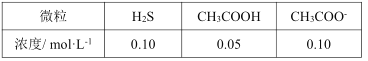
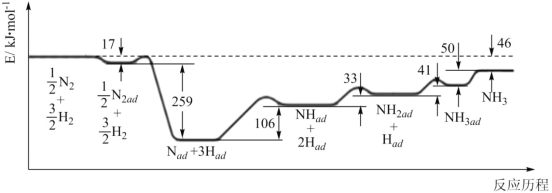
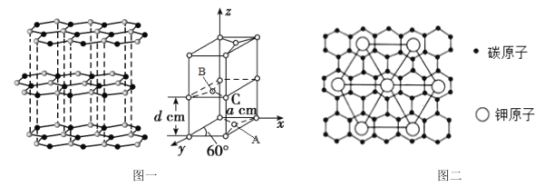
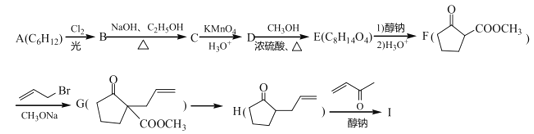
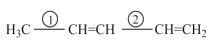 中碳原子的轨道杂化类型为__,分子中两种碳碳单键长的大小关系为①__②(填“>”、“<”或“=”)。
中碳原子的轨道杂化类型为__,分子中两种碳碳单键长的大小关系为①__②(填“>”、“<”或“=”)。