-
化学与环境、科学、技术密切相关。下列有关说法中正确的是( )
A.华为首款5G手机搭载了智能的7nm制程SoC麒麟980芯片,此芯片主要成分是二氧化硅
B.用于制作N95型口罩的“熔喷布”主要原料是聚丙烯,聚丙烯的分子长链上无支链
C.国产飞机C919用到的氮化硅陶瓷是传统有机非金属材料
D.侯氏制碱法的工艺过程中应用了物质溶解度的差异
难度: 简单查看答案及解析
-
NA表示阿伏加德罗常数,下列叙述正确的是( )
A.标准状况下,22.4L盐酸含有NA个HCl分子
B.丙烯和环丙烷组成的42g混合气体中氢原子的个数为6NA
C.1molNa被完全氧化生成Na2O2,失去2NA个电子
D.电解精炼铜时,若转移了NA个电子,则阳极溶解32g铜
难度: 中等查看答案及解析
-
下列装置能达到实验目的的是( )
A.熔化Na2CO3
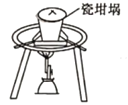
B.保存液溴
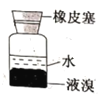
C.分液,先放出水层,再倒出溴的苯溶液

D.进行中和热的测定
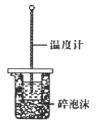
难度: 简单查看答案及解析
-
化合物
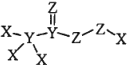 是一种高效消毒剂,其蒸汽和溶液都具有很强的杀菌能力,可用于目前新冠病毒疫情下的生活消毒。其中X、Y、Z 为原子序数依次增大的短周期元素。下列叙述正确的是
是一种高效消毒剂,其蒸汽和溶液都具有很强的杀菌能力,可用于目前新冠病毒疫情下的生活消毒。其中X、Y、Z 为原子序数依次增大的短周期元素。下列叙述正确的是A.原子半径:X>Y>Z
B.元素的非金属性:X<Y<Z
C.该化合物中Z的化合价均呈-2 价
D.该化合物中 X、Y、Z都满足 8 电子稳定结构
难度: 中等查看答案及解析
-
镁一空气电池是一种能被水激活的一次性储备电池,原理如图所示。下列说法错误的是( )
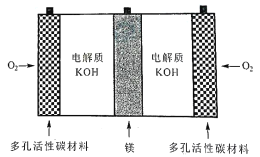
A.放电时,外电路电子由多孔碳材料电极流向镁电极
B.放电时,正极的电极反应式为O2+4e-+2H2O=4OH-
C.理论上,外电路中流过2mol电子时,负极质量增加34g
D.电池反应产物Mg(OH)2经过灼烧与还原可制成镁从而循环利用
难度: 中等查看答案及解析
-
单萜类化合物香叶醇是香精油的主要成分之一。在酸性溶液中,香叶醇可以转化为环状单萜α—松油醇:
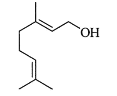
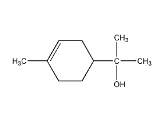
关于香叶醇和α—松油醇,下列说法正确的是( )
A.香叶醇能在铜丝催化下和氧气氧化生成醛,但α—松油醇不能
B.两者互为同分异构体,分子式是C10H20O
C.两者分子中所有原子均处于同一平面
D.两者均能使溴的四氯化碳溶液褪色,是发生消去反应
难度: 中等查看答案及解析
-
常温下,向10mL0.1mol/L的HR溶液中逐滴加入0.1mol/L的氨水,所得溶液pH及导电能力变化如图。下列分析正确的是( )

A.溶液中的阳离子浓度总和最大的是d点
B.常温下,HR的电离平衡常数数量级为10-8
C.b点和d点溶液中,水的电离程度不相等
D.d点的溶液中,微粒浓度关系:c(R-)+2c(HR)=c(NH3∙H2O)
难度: 中等查看答案及解析

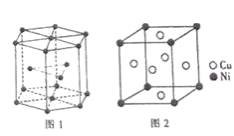
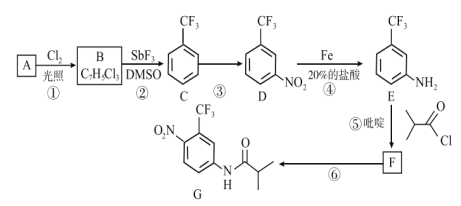
 为原料,经三步合成某化工产品
为原料,经三步合成某化工产品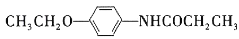 的路线为___(其他无机试剂任)。
的路线为___(其他无机试剂任)。