-
生活因化学更美好。下列说法错误的是
A.氯化铵溶液常用作除锈剂
B.聚乙烯塑料薄膜可用作食品包装袋
C.硫酸钡常用于胃肠X射线造影检查
D.活性炭可用于除去冰箱的异味,此外还具有杀菌作用
难度: 简单查看答案及解析
-
下列说法正确的是
A.糖类和蛋白质都是天然高分子化合物
B.以淀粉为原料可制取乙酸乙酯
C.氨气经催化氧化生成NO属于氮的固定
D.用Ba(OH)2溶液可以鉴别碳酸钠溶液和碳酸氢钠溶液
难度: 简单查看答案及解析
-
有机物M(HOCH2CH=CHCH2OH)是一种有机合成中间体,下列关于M的说法不正确的是
A.能溶于水 B.不存在顺反异构
C.可以发生加聚反应 D.同分异构体中属于酯类的有4种
难度: 简单查看答案及解析
-
前20号主族元素W、X、Y、Z的原子序数依次增大,W的氢化物可腐蚀玻璃,1molX的最高价氧化物对应水化物需要用3molNaOH才能中和,Y-与Z+具有相同的电子层结构。下列说法正确的是
A.标准状态下W的氢化物为气体
B.离子半径:X<Y<Z
C.Z的氢化物为离子化合物
D.X和Y形成的化合物中各原子均满足8电子稳定结构
难度: 中等查看答案及解析
-
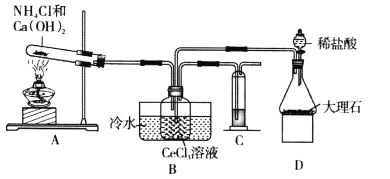
三氯化硼(BCl3)是一种重要的化工原料。某实验小组利用干燥的氯气和下列装置(装置可重复使用)制备BCl3并验证反应中有CO生成。
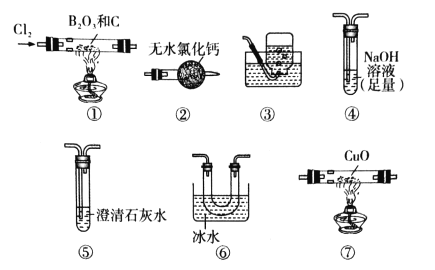
已知:i.实验室制备BCl3的化学方程式为:B2O3+3C+3Cl2
2BCl3+3CO;
ii.BCl3的熔点为-107.3℃,沸点为12.5℃,遇水水解生成H3BO3和HCl。下列说法不正确的是
A.实验装置合理的连接顺序为①⑥④②⑦⑤③
B.装置④中发生反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O
C.装置⑥的作用是冷凝并收集BCl3
D.验证有CO生成的现象是装置⑦中CuO由黑色变成红色,且装置⑤中澄清石灰水变浑浊
难度: 困难查看答案及解析
-
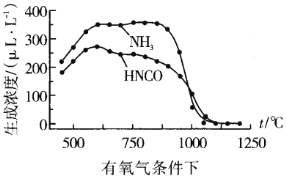
我国是煤炭消费大国,高硫煤(主要含FeS2)在我国煤炭消费中占有相当大的比例,其燃烧时产生的SO2对环境和人体健康造成了一定的负面影响,所以运用电化学法进行煤的燃前脱硫是一项具有前景的技术。已知:2FeS2+7O2+8NaOH=2Fe(OH)2+4Na2SO4+2H2O,图甲是模拟电化学法脱硫的示意图(电极均为惰性电极),对此方法说法不正确的是
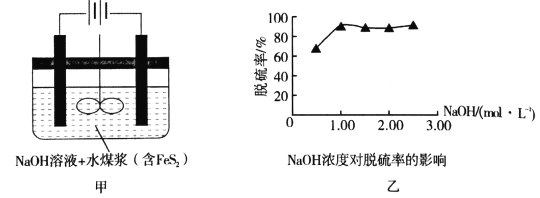
A.将煤制成水煤浆加入电解槽有利于反应的充分进行
B.阳极的电极反应式为4OH--4e-=O2↑+2H2O
C.煤中的铁元素最终以Fe(OH)2的形式存在
D.根据图乙中的信息,NaOH溶液的适宜浓度为1mol/L
难度: 困难查看答案及解析
-
Fe3+与SO32-不能大量共存的原因是存在氧化还原反应和双水解反应之争。如图是利用手持技术测量向FeCl3溶液滴加Na2SO3溶液过程中的pH和电导率的变化情况:
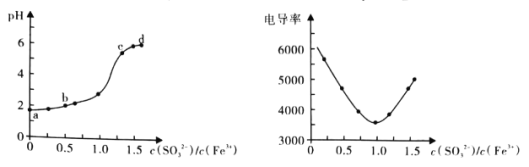
实验过程还发现:
i.b点时溶液澄清透明,向其中分别加入KSCN溶液和NaOH溶液,现象分别为出现血红色和灰绿色难溶物;
ii.c点和d点均出现明显红褐色难溶物,取上层清液,分别加入KSCN溶液和NaOH溶液,现象分别为出现血红色和无明显变化。
结合以上信息,下列分析不合理的是
A.a点溶液在配置时需加入盐酸
B.结合b点附近pH的变化以及实验现象,说明此处发生了氧化还原反应
C.c点溶液中发生的主要反应为2Fe3++3SO32-+6H2O=2Fe(OH)3↓+3H2SO3
D.取d点处上层清液,向其中滴加K3[Fe(CN)6],溶液会出现蓝色沉淀
难度: 困难查看答案及解析