-
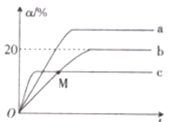
已知,常温下,KSP(AgCl)=1.8×10-10mol2·L-2,KSP(AgI)=8.3×10-17mol2·L-2,下列叙述中,正确的是
A.常温下,AgCl在饱和NaCl溶液中的KSP比在纯水中的KSP小
B.向AgCl的悬浊液中加入KI溶液,沉淀由白色转化为黄色
C.将0.001 mol·L-1的AgNO3溶液滴入KCl和KI的混合溶液中,一定先产生AgI沉淀
D.向AgCl的饱和溶液中加入NaCl晶体,有AgCl析出且溶液中c(Ag+)=c(Cl-)
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.制取Fe(OH)3胶体:Fe3+ +3H2O
Fe(OH)3↓ + 3H+
B.锅炉除水垢时先用纯碱浸泡:CaSO4 + CO32-= CaCO3+ SO42-
C.泡沫灭火器灭火原理:2Al3+ + 3CO32-+ 3H2O =2Al(OH)3↓+3CO2↑
D.碳酸钠溶液显碱性:CO32-+2H2O⇌H2CO3+2OH-
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.标准状况下,22.4 LSO2和SO3混合物中含有的硫原子数目为0.1NA
B.氢氧燃料电池负极消耗1.12L气体时,电路中转移的电子数为0.1NA
C.1mol NaHSO4在熔融状态下电离出的阳离子数为0.2NA
D.在1L 0.5mol/L的Na2CO3溶液中,阴离子总数大于0.5NA
难度: 中等查看答案及解析
-
金属(M)-空气电池的工作原理如图所示。下列说法不正确的是
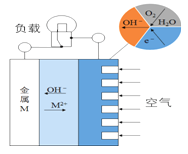
A.金属M作电池负极
B.电解质是熔融的MO
C.正极的电极反应
D.电池反应
难度: 中等查看答案及解析
-
醋酸钡晶体[(CH3COO)2Ba·H2O]是一种媒染剂,下列有关0.1mol·L-1醋酸钡溶液中粒子浓度的比较中错误的是( )
A.c(H+)=c(OH-)-c(CH3COOH)
B.c(H+) +2c(Ba2+)=c(CH3COO-) + c(OH-)
C.c(Ba2+ )>c(CH3COO-)>c(OH-)>c(H+)
D.2c(Ba2+)=c(CH3COO-) + c(CH3COOH)
难度: 困难查看答案及解析
-
在3 种不同条件下,分别向容积为2L的恒容密闭容器中充入2 molA和1mol B,发生反应: 2A(g)+B(g)
2D(g)△H=QkJ/mol。相关条件和数据见下表:
实验编号
实验I
实验II
实验III
反应温度/℃
700
700
750
达平衡时间/min
40
50
30
n(D)平衡/mol
1.5
1.5
1
化学平衡常数
K1
K2
K3
下列说法正确的是
A.升高温度能加快反应速率的原理是降低了反应的活化能,使活化分子百分数提高
B.实验III达平衡后,保持其他条件不变,再向容器中通入1molA 和1molD,平衡不移动
C.实验III达平衡后容器内的压强是实验1的9/10倍
D.K3>K2>K1
难度: 中等查看答案及解析