-
实验室欲配制1.00mol/L的NaCl溶液80mL。下列说法正确的是
A. 选用100mL容量瓶,并用蒸馏水洗净后烘干
B. 用托盘天平称取5.9g NaCl固体倒入容量瓶中溶解
C. 定容时俯视刻度线会导致所配溶液浓度偏高
D. 摇匀、静置后发现凹液面低于刻度线1~2mm,用胶头滴管加水至与刻度线相平即可
难度: 中等查看答案及解析
-
SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:
①SO2+2Fe3++2H2O=SO42-+2Fe2++4H+;
②Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
下列有关说法错误的是 ( )
A. 氧化性:Cr2O72->Fe3+>SO2
B. K2Cr2O7能将Na2SO3氧化成Na2SO4
C. 每有1 mol K2Cr2O7参加反应,转移电子的数目为6NA
D. 若有6.72 L SO2(标准状况)参加反应,则最终消耗0.2 mol K2Cr2O7
难度: 中等查看答案及解析
-
离子方程式Ba2++SO42-=BaSO4↓它可能表示( )
①可溶性钡盐溶液与可溶性硫酸盐溶液之间的反应
②氢氧化钡溶液与可溶性硫酸盐溶液之间的反应
③稀硫酸与可溶性钡盐溶液之间的反应
④氢氧化钡溶液与稀硫酸反应
A.①② B.①②④ C.②③ D.①②③
难度: 中等查看答案及解析
-
金属钠投入水中发生剧烈反应,并有氢气生成。装运金属钠的包装箱应贴的图标是
A.
 B.
B. C.
C. D.
D.
难度: 简单查看答案及解析
-
现有三组洛液:①汽油和氯化钠溶液: ②39%的酒精溶液:③氯化钠和单质溴的水溶液。分离以上各混合液的正确方法依次是
A.过滤、萃取、分液 B.萃取、分液、蒸馏
C.分液、蒸馏、萃取 D.萃取、蒸馏、分液
难度: 简单查看答案及解析
-
下列叙述正确的是
①1molH2O中含有2mol氢和2mol氧
②在相同条件下,相同物质的量的CO、N2的混合气体与O2的分子个数相同,原子个数也相同
③0.012kg12C中含有约6.02×1023个碳原子
④Na2O的摩尔质量为62
⑤1 molN2的质量与它的相对分子质量相等
⑥2mol水的摩尔质量是1mol水的摩尔质量的2倍
A.②③ B.①②③④ C.⑤⑥ D.②⑤⑥
难度: 中等查看答案及解析
-
现有N2和O2的混合气体,其总质量为144g,总物质的量为5mol,则O2和N2的物质的量之比为
A.1:4 B.2:3 C.3:2 D.4:1
难度: 简单查看答案及解析
-
下列说法正确的是
A.硫酸、磷酸的摩尔质量均为98g
B.20℃、1.0×10 5Pa时,同体积的O2与CO2含有相同的分子数
C.标准状况下,16gO2与24g Mg所占的体积相同
D.当1mol气态物质的体积为22.4L时,该气体一定处于标准状况
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数,如果ag某气态双原子分子的分子数为p,则bg该气体在标准状况下的体积是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数,则下列叙述中正确的是
A. 6.02×1022个H2SO分子在水中可电离生成2NA个H+
B. 在0℃、101kPa时,22.4L氢气中含有NA个氢原子
C. 14g氮气中含有7NA个电子
D. NA个一氧化碳分子和0.5mol甲烷的质量比为7︰4
难度: 中等查看答案及解析
-
用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范的是( )
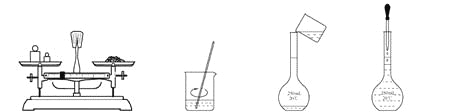
A. 称量 B. 溶解 C. 转移 D. 定容
难度: 中等查看答案及解析
-
下列关于物质的量浓度表述正确的是
A. 0.3 mol·L-1的Na2SO4溶液中含有Na+和SO42-的总物质的量为0.9 mol
B. 当1 L水吸收22.4 L氨气时所得氨水的浓度不是1 mol·L-1,只有当22.4 L氨气溶于水制得1 L氨水时,其浓度才是1 mol·L-1
C. 在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相同
D. 10 ℃时,100 mL 0.35 mol·L-1的KCl饱和溶液蒸发掉5 g水,冷却到10 ℃时,其体积小于100 mL,它的物质的量浓度仍为0.35 mol·L-1
难度: 中等查看答案及解析
-
下列分散系能产生“丁达尔效应”的是
A.稀硫酸 B.硫酸铜溶液 C.氢氧化铁胶体 D.酒精溶液
难度: 简单查看答案及解析
-
下列有关分散系的叙述不正确的是
A.胶体是分散系的一种, 它只是物质的一种存在形式
B.氢氧化铁胶体与三氯化铁溶液的本质区别是能否产生丁达尔效应
C.溶液的分散质可通过半透膜,而浊液的分散质则不能通过半透膜
D.NaCl固体分散在水里形成溶液,难溶于苯
难度: 简单查看答案及解析
-
把0.1 mol KOH固体分别加入到下列100 mL的液体中,溶液的导电能力无变化的是( )
A.纯净水 B.0.l mol/L HCl
C.1.0 mol/L CH3COOH D.0.5 mol/L H2SO4
难度: 简单查看答案及解析
-
只能表示一个化学反应的离子方程式是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
向含Fe(NO3)3、Cu(NO3)2、HNO3的稀溶液中逐渐加入铁粉,c(Fe2+)的变化如图所示。下列离子方程式错误的是
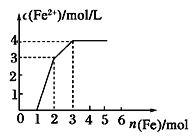
A.0~1:Fe+NO3-+4H+=Fe3++NO↑+2H2O
B.1~2:Fe+2Fe3+=3Fe2+
C.2~3:Fe+Cu2+=Fe2++Cu
D.0~3:3Fe+2Fe3++2Cu2+=5Fe2++2Cu
难度: 中等查看答案及解析
-
室温下,下列各组离子在指定溶液中能大量共存的是( )
A.0.1mol/L KI溶液: Na+、K+、ClO-、H+
B.0.1mol/L Fe2(SO4)3溶液:Cu2+、NH4+、NO3-、SO42-
C.0.1mol/L HCl溶液:Ba2+、K+、CH3COO-、NO3-
D.0.1mol/L NAOH溶液:Mg2+、Na+、SO42-、HCO3-
难度: 中等查看答案及解析
-
下列关于离子检验与推断的叙述不正确的是
A.向某溶液中加入浓氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,则原溶液中存在NH4+
B.加入KOH溶液,有红褐色沉淀生成,证明原溶液中含有Fe3+
C.向某溶液中加入硝酸酸化的硝酸银溶液,有白沉淀生成,证明原溶液中存在Cl-
D.某溶液加入CCl4, CCl4层显紫色,证明源溶液中含有I-
难度: 中等查看答案及解析
-
下列化学反应的离子方程式错误的是
A.氯化钡溶液与硫酸钾溶液的反应:Ba2++SO42-=BaSO4↓
B.氢氧化钠溶液与硝酸的反应: OH-+H+=H2O
C.碳酸钠溶液与硫酸的反应: CO32- + 2H+=CO2↑+H2O
D.碳酸钙与盐酸的反应: CO32- + 2H+=CO2↑+H2O
难度: 中等查看答案及解析
-
中国传统文化对人类文明贡献巨大,古代文献中充分记载了古代化学研究成果。我国晋代《抱朴子》中描述了大量的化学反应,其中有:①“丹砂(HgS)烧之成水银,积变又还成丹砂”:②"以曾青涂铁,铁赤色如铜”。下列有关叙述正确的是
A.①中水银“积变又还成丹砂”说明水银发生了还原反应
B.②中反应的离子方程式为2Fe+ 3Cu+=2Fe3++3Cu
C.根据①可知温度计打破后可以用硫粉覆盖水银,防止中毒
D.水银能跟曾青发生置换反应生成单质铜
难度: 中等查看答案及解析
-
已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列反应在水资液中不可能发生的是( )
A.3Cl2+ 6FeI2=2FeCl3+4FeI3
B.Cl2+FeI2=FeCl2+I2
C.Co2O3+6HCl(浓)=2CoCl2+Cl2↑+3H2O
D.2Fe3++ 2I-=2Fe2++ I2
难度: 困难查看答案及解析
-
向盛有一定量的Ba(OH)2溶液中逐滴加入稀硫酸,直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)近似的用下图中的曲线表示是( )

A. A B. B C. C D. D
难度: 中等查看答案及解析
-
亚硝酸钠(NaNO2)既可以作氧化剂又可以作还原剂,当它在反应中作氧化剂时,可能生成的产物是( )
A.N2 B.N2O3 C.HNO3 D.NO2
难度: 简单查看答案及解析
-
某容器中发生一个化学反应,反应过程中存在Fe2+、NO3-、Fe3+、NH4+、H+和水六种粒子,在反应过程中测得Fe3+、NO3-的物质的量随时间变化的曲线如图所示,下列有关判断错误的是( )
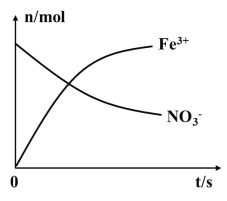
A.在反应中NO3-被还原,发生还原反应
B.还原性:Fe2+>NH4+
C.该反应中Fe2+被氧化为Fe3+
D.在反应中参加反应的还原剂与氧化剂的物质的量之比为6:1
难度: 困难查看答案及解析