-
下列各组物质属于同素异形体的是( )
A.16O和18O B.金刚石、石墨和富勒烯(C60)
C.NaCl和KCl D.H2O和H2O2
难度: 简单查看答案及解析
-
下列关于浓硝酸和浓硫酸的叙述正确的是( )
A.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
B.浓硝酸具有不稳定性,实验室里应保存在棕色瓶中
C.常温下,浓硝酸可以跟铜缓慢反应,浓硫酸可与铜片迅速反应
D.实验室可以用浓硝酸来制氢气
难度: 简单查看答案及解析
-
一定量的浓硝酸与过量的铜充分反应,生成的气体是( )
A.只有NO2 B.只有NO C.NO2和NO D.NO2和H2
难度: 简单查看答案及解析
-
在8NH3+3Cl2====6NH4Cl+N2反应中,若有2 mol N2生成,发生氧化反应的NH3的物质的量是 ( )
A.16 mol B.8 mol C.4 mol D.3 mol
难度: 简单查看答案及解析
-
为除去CO2气体中混有的少量杂质SO2气体,应选用的试剂是( )
A.Na2CO3溶液 B.NaHCO3溶液 C.NaOH溶液 D.NaHSO3溶液
难度: 简单查看答案及解析
-
已知一定条件下硫酸铵分解反应为 4(NH4)2SO4== N2↑ +6NH3 ↑+3SO2 ↑+SO3 ↑+7H2O。将硫酸铵分解反应后的混合气体通入氯化钡溶液中,下列判断正确的是( )
A.得到的沉淀是BaSO4 B.得到的沉淀是BaSO4和BaSO3
C.一定无BaSO3生成 D.无沉淀生成
难度: 简单查看答案及解析
-
关于SO2的叙述,正确的是( )
A.可使石蕊试液褪色 B.与水作用生成H2SO4
C.不能与过氧化氢(H2O2)溶液反应 D.能使品红褪色,加热后又出现红色
难度: 简单查看答案及解析
-
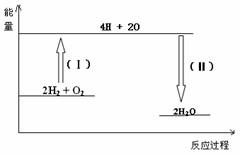
接触法制硫酸和氨氧化法制硝酸分别经过以下主要变化:
下列说法中正确的是( )
A.所有变化都是氧化还原反应
B.2、3、4、5等四个反应都是化合反应
C.反应2、4、6需要催化剂
D.3是化合反应 , 6是氧化还原反应
难度: 简单查看答案及解析
-
下列离子方程式错误的是( )
A.在氯化铝溶液中通入过量的氨气:Al3+ + 3OH- == Al(OH)3↓
B.硫酸铵溶液中加入浓氢氧化钠溶液并加热:NH4+ +OH- == NH3↑ + H2O
C.二氧化硫通入氯水中:SO2 +Cl2 +2H2O ==4H+ +SO42- +2Cl-
D.二氧化硫通入过量NaOH溶液中:SO2 + 2OH- == SO32- +H2O
难度: 简单查看答案及解析
-
下列检验铵盐的方法中正确的是( )
A.加热,用湿润的红色石蕊试纸靠近试管口检验
B.加水溶解,用红色石蕊试纸检验溶液的酸碱性
C.加入碱溶液,加热,再滴入酚酞试液
D.加入氢氧化钠溶液加热,用湿润的红色石蕊试纸在试管口检验
难度: 简单查看答案及解析
-
短周期元素W、X、Y、Z在元素周期表中的位置如图所示。下列说法中正确的是( )
A.W的最高价氧化物对应的水化物是强酸
B.Y的原子半径在同周期主族元素中最大
C.W的非金属性比Z的弱
D.Z的气态氢化物的稳定性在同主族元素中最强
难度: 简单查看答案及解析
-
下列原子序数所对应的元素组中,两者可形成离子键的是( )
A.1和17 B.12和9 C.14和6 D.15和8
难度: 简单查看答案及解析
-
氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是( )
A.一个D2O分子所含有的中子数为8 B.热稳定性:H2S >HF
C.NH3的结构式为:
D.HCl的电子式为:
难度: 简单查看答案及解析
-
某主族元素最外层只有1个电子,则该元素一定是( )
A.ⅠA族元素 B.第ⅦA元素 C.第三周期元素 D.金属元素
难度: 简单查看答案及解析
-
XY2 是离子化合物,X和Y的离子的电子层结构与氖原子的相同,则X、Y为 ( )
A.Na和Cl B.K和S C.Ca和F D.Mg和F
难度: 简单查看答案及解析
-
下列叙述不正确的是( )
A.酸能电离出H+和酸根离子,故酸为离子化合物
B.共价化合物分子中一定含有共价键
C.氢氧化钡晶体与氯化铵固体的反应是吸收热量的反应
D.需加热的反应不一定是吸热反应
难度: 简单查看答案及解析
-
“1998中国十大科技成果”之一是合成一维纳米氮化镓,已知镓(Ga)是ⅢA族元素,则氮化镓的化学式可能是( )
A.Ga3N2 B.Ga2N3 C.GaN D.Ga3N
难度: 简单查看答案及解析
-
下列递变情况正确的是( )
A.Na、Mg、Al最外层电子数依次增多,其还原性依次增强
B.P、S、Cl最高正价依次升高,对应气态氢化物稳定性依次增强
C.C、N、O原子半径依次增大
D.Na和K属于第ⅠA族元素,其氧化物的水化物碱性:NaOH比KOH强
难度: 简单查看答案及解析
-
下列物质中属于只含有共价键的化合物的是( )
A.HI B.NaOH C.Br2 D.NaCl
难度: 简单查看答案及解析
-
火山爆发产生的气体中含有1%的羰基硫(化学式为COS,C===O就是羰基),已知羰基硫分子中所有原子最外层均满足8电子稳定结构,结合元素周期表知识,下列有关说法正确的是( )
A.羰基硫中O为-2价,C、S都是+1价
B.羰基硫分子中共含有3个原子核、16个电子
C.羰基硫分子结构中只含有共价键
D.羰基硫的电子式为
难度: 简单查看答案及解析
-
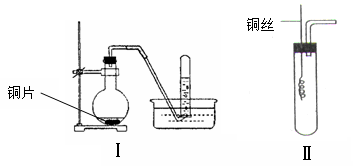
下列关于化学反应速率的说法中正确的是( )
A.对任何化学反应来说,反应速率越大,反应现象就越明显
B.决定化学反应速率的主要因素是反应物的浓度
C.若某化学反应的反应速率为0.5mol·(L·S)-1就是指在该时间内反应物和生成物的浓度变化都为0.5 mol·L-1
D.化学反应速率用于衡量化学反应进行的快慢
难度: 简单查看答案及解析
-
现把镁条投入到盛有盐酸的敞口容器中,产生H2的速率如图所示。在下列因素中对产生H2速率没有影响的是( )
A.溶液的温度 B.镁条的表面积
C.Cl-的浓度 D.H+的浓度
难度: 简单查看答案及解析
-
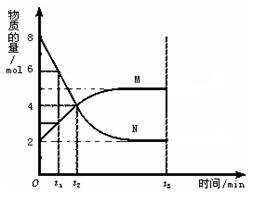
N2 +3 H2
2NH3现向一密闭容器中充入1mol N2和3mol H2,在一定条件下使该反应发生,下列有关说法正确的是( )
A.达到化学平衡时,N2将完全转化为NH3
B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
D.达到化学平衡时,正、逆反应速率为0
难度: 简单查看答案及解析
-
对于锌铜和稀硫酸构成的原电池的电极名称叙述有错误的是( )
A.发生氧化反应的为负极 B.正极为电子流入的一极
C.比较不活泼的金属铜为负极 D.电流的方向由正极到负极
难度: 简单查看答案及解析
-
N2H4是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则下列热化学方程式中正确的是( )
A.1/2 N2H4(g)+1/2O2(g)===1/2 N2(g)+H2O(g) ΔH=+267 kJ·mol-1
B.N2H4(g)+O2(g)===N2(g)+2H2O(l) ΔH=-133.5 kJ·mol-1
C.N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=+534 kJ·mol-1
D.N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ·mol-1
难度: 简单查看答案及解析