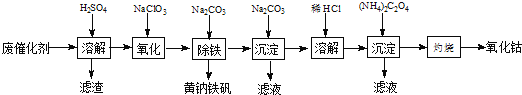
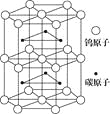
-
主族元素X、Y、Z、W、R、T的原子序数依次增大,且均不大于20。其中X-的电子层结构与氦相同,R和Y同族,Y元素的某种单质是一种自来水消毒剂;Z3+和Y2-具有相同的电子层结构;T、W、Y三种元素组成盐T2WY3的溶液通入过量CO2后产生白色沉淀。下列说法不正确的是( )
A. 原子半径:T>R>W>Z
B. T和R形成化合物的水溶液呈碱性
C. 化合物TX具有很强的还原性,可与水反应
D. T、R、Z三种元素的最高价氧化物对应的水化物两两能发生反应
难度: 中等查看答案及解析
-
化学与生活、社会密切相关。下列说法正确的是
A. 苏打是面包发酵粉的主要成分 B. 汽油和乙烯均为石油分馏得到的产品
C. CaO可作工业废气的脱硫剂 D. 蔗糖、淀粉、油脂的水解产物均为非电解质
难度: 中等查看答案及解析
-
下列实验操作、现象和所得出结论正确的是( )
选项
实验操作
实验现象
实验结论
A
向淀粉溶液中加入稀硫酸,加热一段时间后,再加入新制Cu(OH)2,加热
没有出现砖红色沉淀
淀粉没有水解
B
取少量Mg(OH)2悬浊液,向其中滴加适量浓CH3COONH4溶液
Mg(OH)2溶解
CH3COONH4溶液呈酸性
C
将浸透石蜡油的石棉放置在硬质试管底部,加入少量碎瓷片并加强热,将生成的气体通入酸性高锰酸钾溶液中
酸性高锰酸钾溶液褪色
石蜡油分解产物中含有不饱和烃
D
将海带剪碎,灼烧成灰,加蒸馏水浸泡,取滤液滴加硫酸溶液,再加入淀粉溶液
溶液变蓝
海带中含有丰富的I2
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值。下列判断正确的是
A.标准状况下,2.24L苯中含有碳碳双键数为0.3NA
B.6.4gS2、S4和S8的混合物中所含硫原子数为0.2NA
C.1L0.1mol·L-1的氢碘酸中含碘化氢分子数为0.1NA
D.60g乙酸与足量乙醇发生酯化反应时断裂的C-O键数为NA
难度: 中等查看答案及解析
-
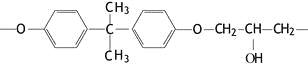
萘乙酸甲酯是具有生长素活性的植物生长调节剂,农业上可用于抑制马铃薯块茎贮藏期发芽等,其结构如图所示,下列有关萘乙酸甲酯的判断错误的是
A. 其在水中和苯中的溶解度均较大
B. 属于芳香化合物,分子式为C13H12O2
C. 能发生水解反应、氧化反应和加成反应
D. 其一氯取代产物共有9种(不考虑立体异构体)
难度: 中等查看答案及解析
-
当电解质中某离子的浓度越大时,其氧化性或还原性越强,利用这一性质,有人设计出如图所示“浓差电池”(其电动势取决于物质的浓度差,是由一种物质从高浓度向低浓度转移而产生的)。其中,甲池为3mol·L-1的AgNO3溶液,乙池为1mol·L-1的AgNO3溶液A、B均为Ag电极。实验开始先断开K1,闭合K2,发现电流计指针发生偏转。下列说法不正确的是
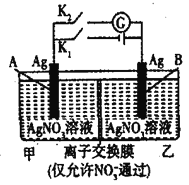
A. 当电流计指针归零后,断开K2,闭合K1,一段时间后B电极的质量增加
B. 断开K1,闭合K2,一段时间后电流计指针归零,此时两池银离子浓度相等
C. 实验开始先断开K1,闭合K2,此时NO3-向B电极移动
D. 当电流计指针归零后,断开K2闭合K1,乙池溶液浓度增大
难度: 困难查看答案及解析
-
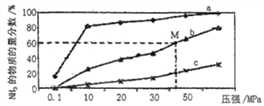
室温下,向10mL0.1mol·L-1HX溶液中逐滴加入0.2mol·L-1YOH溶液,混合溶液的pH变化情况如图所示(温度和体积变化忽略不计)。则下列结论错误的是
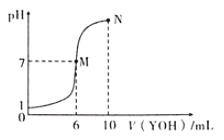
A.HX为一元强酸,YOH为一元弱碱。
B.M点水的电离程度大于N点水的电离程度
C.N点对应溶液中粒子浓度:c(YOH)>c(Y+)>c(X-)>c(OH-)>c(H+)
D.25℃时pH=4的YX溶液中水电离出的c(H+)=1.0×10-4mol·L-1
难度: 中等查看答案及解析
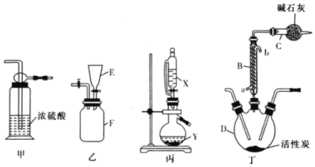
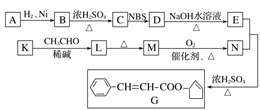
 B…
B…