-
新冠肺炎疫情出现以来,一系列举措体现了中国力量。在各种防护防控措施中,化学知识起到了重要作用。下列有关说法不正确的是
A.“ 84 消毒液”(主要成份NaClO) 消毒是利用ClO- 的强氧化性,高温消毒是利用高温可使蛋白质发生变性
B.新冠病毒(直径大约在60 ~ 140 nm),扩散到空气中不可能形成胶体,酒精杀菌消毒不可能发生化学变化
C.N95 型口罩的核心材料是聚丙烯,属于有机高分子材料
D.医用防护服的核心材料是微孔聚四氟乙烯薄膜,其单体四氟乙烯属于卤代烃
难度: 简单查看答案及解析
-
化合物1,1二环丙基乙烯
是重要的医药中间体。下列有关该化合物的说法正确的是
A.分子中所有碳原子共平面 B.其同分异构体可能是苯的同系物
C.一氯代物有4种 D.可以发生加成反应、氧化反应和加聚反应
难度: 中等查看答案及解析
-
NA 表示阿伏加德罗常数的值。下列关于1 L 0. lmo/L FeCl3溶液的说法中正确的是
A.加热煮沸至溶液呈红褐色时,得到0. 1 NA Fe( OH)3 胶体粒子
B.室温下,加水稀释后,溶液中 c(OH- ) 减小
C.加入0. 3 mol KSCN 溶液,生成0. 1 mol Fe(SCN)3 的红色物质
D.加入0. 15 mol NaOH 固体后 ,3c( Fe3 + ) +c(H+) =c(Na+) +c(OH-)
难度: 中等查看答案及解析
-
由下列实验及现象推出相应结论正确的是
选项
实验
现象
结论
A
①某溶液中加入Ba(NO3)2溶液
②再加足量盐酸
①产生白色沉淀
②仍有白色沉淀
原溶液中有SO42-
B
将表面有黑色CuO的热铜丝插入乙醇中,反复多次
闻到有刺激性气味,铜丝变光亮
乙醇被氧化
C
将甲烷与氯气按体积比1:4混合于试管中,光照
反应后的混合气体能使湿润的石蕊试纸变红
生成的氯代甲烷具有酸性
D
将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置
下层液体显紫红色
氧化性:Fe3+<I2
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W 的原子序数依次增大,X 原子核外最外层电子数是其内层电子数的2 倍,Y是地壳中含量最高的元素,常温下,0. 01 mol•L-1 Z的最高价氧化物对应的水化物溶液的pH = 12, W 在元素周期表中的族序数是周期数的2 倍。下列说法正确的是
A.W 的单质的氧化性比 Y 的强
B.原子半径:r(Z) >r(W) >r(Y) >r(X)
C.工业上常用电解法冶炼 Z 单质
D.最高价氧化物对应的水化物的酸性: X>W
难度: 中等查看答案及解析
-
在两只锥形瓶中分别加入浓度均为l mol•L-1 的盐酸和NH4Cl溶液,将温度和pH 传感器与溶液相连,往瓶中同时加入过量的质量、形状均相同的镁条,实验结果如下图。关于该实验的下列说法,正确的是
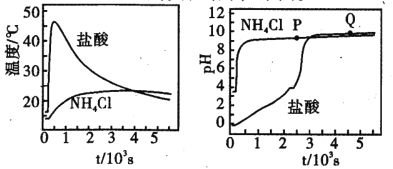
A.P点溶液:c(NH4+) + 2c(Mg2+) >c(Cl-)
B.反应剧烈程度:NH4Cl >HCl
C.Q点溶液显碱性是因为MgCl2发生水解
D.1000s后,镁与NH4Cl溶液反应停止
难度: 中等查看答案及解析
-
2019 年 11 月《Science》杂志报道了王浩天教授团队发明的制取H2O2 的绿色方法,原理如图所示(已知:H2O2
H+ + H2O , Ka = 2. 4×10一12 )下列说法不正确的是
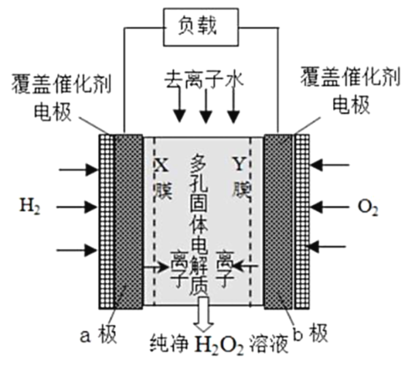
A.b 极上的电极反应为O2 +H2O +2e- =HO2 - +OH
B.X 膜为选择性阳离子交换膜
C.催化剂可促进反应中电子的转移,加快反应速率
D.每生成1 mol H2O2 电极上流过4 mole-
难度: 中等查看答案及解析
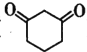 )常用作医药中间体,用于有机合成。下列是一种合成1,3-环己二酮的路线。
)常用作医药中间体,用于有机合成。下列是一种合成1,3-环己二酮的路线。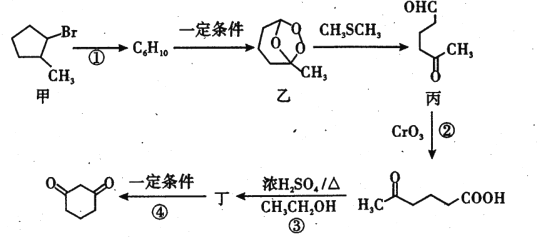
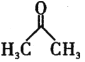 (丙酮)为原料制备
(丙酮)为原料制备