-
下列说法中肯定错误的是( )
A. 某原子K层上只有一个电子
B. 某原子M层上电子数为L层上电子数的4倍
C. 某离子M层上和L层上的电子数均为K层的4倍
D. 某原子的核电荷数与最外层电子数相等
难度: 中等查看答案及解析
-
镭是元素周期表中第ⅡA族元素,下列关于镭的叙述不正确的是
A.镭比钙的金属性更强 B.在化合物中呈+2价
C.镭是一种放射性元素 D.氢氧化镭呈两性
难度: 中等查看答案及解析
-
X、Y是元素周期表ⅦA族中的两种元素。下列叙述中能说明X的非金属性比Y强的是
A.X原子的电子层数比Y原子的电子层数多
B.X的氢化物的沸点比Y的氢化物的沸点低
C.X的气态氢化物比Y的气态氢化物稳定
D.Y的单质能将X从NaX的溶液中置换出来
难度: 中等查看答案及解析
-
下列说法正确的是
A.形成离子键的阴阳离子间只存在静电吸引力
B.HF、HCl、HBr、HI的热稳定性和还原性均依次减弱
C.第三周期非金属元素含氧酸的酸性从左到右依次增强
D.元素周期律是元素原子核外电子排布周期性变化的结果
难度: 简单查看答案及解析
-
在通常情况下能大量共存,并且可以用浓硫酸干燥的一组气体是( )
A.SO2、H2S、O2
B.CO、H2、Cl2
C.NO、H2、O2
D.HCl、CO、NH3
难度: 简单查看答案及解析
-
下列关于SiO2和CO2的说法中正确的是 ( )
A.CO2、SiO2都能与碱及碱性氧化物反应
B.CO2和SiO2与水反应分别生成相应的酸
C.二氧化硅可用来制作干燥剂,因二氧化硅可与水反应
D.CO2和SiO2都是由相应的分子构成的
难度: 中等查看答案及解析
-
由下列实验事实得出的结论正确的是( )
A.由SiO2不能与水反应生成H2SiO3,可知SiO2不是酸性氧化物
B.由SiO2+2C
Si+2CO↑,可知碳的非金属性大于硅
C.CO2通入Na2SiO3溶液产生白色沉淀,可知酸性H2CO3>H2SiO3
D.SiO2与NaOH溶液反应,也可与氢氟酸反应,则SiO2为两性氧化物
难度: 中等查看答案及解析
-
月球的矿产资源极为丰富,仅月面表层5 cm厚的沙土就含铁单质有上亿吨,月球上的主要矿物有辉石[CaMgSi2O6]、斜长石 [KAlSi3O8] 和橄榄石[(Mg或Fe)2SiO4]等,下列说法或分析不正确的是
A.辉石、斜长石及橄榄石均属于硅酸盐矿
B.橄榄石中铁为+2价
C.月球表层沙土中有游离态铁是因为月球的表面几乎没有氧气
D.斜长石的氧化物形式可表示为:K2O·Al2O3·3SiO2
难度: 中等查看答案及解析
-
某同学在一张pH试纸上滴几滴新制的氯水,现象如图所示,下列有关该实验的说法中正确的是( )
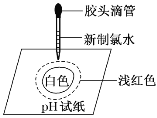
A.该实验说明Cl2分子具有漂白性
B.该实验说明氯水显酸性
C.将实验后的pH试纸在酒精灯上微热,试纸又恢复为原来的颜色
D.若用久置的氯水进行实验,现象相同
难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
①氯气与水反应:Cl2+H2O===2H++Cl-+ClO-
②氯气与氢氧化钠溶液反应:Cl2+2OH-===Cl-+ClO-+H2O
③浓盐酸与二氧化锰共热:MnO2+4HCl
Mn2++2Cl-+Cl2↑+2H2O
④漂白粉溶液中通入少量的二氧化碳气体:Ca2++2ClO-+H2O+CO2===CaCO3↓+2HClO
A.①③ B.②④ C.②③ D.①④
难度: 中等查看答案及解析
-
某同学进行SO2的性质实验。向a、b、c三种试剂中分别通入SO2气体,一段时间后观察到的实验现象如下表所示:
序号
试剂
实验现象
a
溴水
橙色褪去
b
品红溶液
红色褪去
c
酸性KMnO4溶液
紫色褪去
d
NaOH溶液(含2滴酚酞)
红色褪去
下列说法正确的是( )
A.abcd均可用于吸收SO2
B.a、b均表明SO2具有漂白性
C.a、c均表现SO2具有还原性
D.d中只可能发生反应:SO2+2OH-=SO32-+H2O
难度: 中等查看答案及解析
-
将少量浓硫酸倒入盛有蔗糖的小烧杯中,搅拌后观察现象,下列描述正确的是( )
A.实验中浓硫酸表现强酸性
B.蔗糖变黑,表明浓硫酸具有吸水性
C.实验中可闻到刺激性气味的气体,表明浓硫酸具有脱水性
D.该实验会生成两种气体,并可证明浓硫酸具有强氧化性
难度: 中等查看答案及解析
-
足量的铁和下列酸反应,产生H2的物质的量最多的是( )
A.10mL 18.4mol/L H2SO4 B.30mL 3mol/L盐酸
C.30mL 2mol/L H2SO4 D.30mL 5mol/L HNO3
难度: 中等查看答案及解析
-
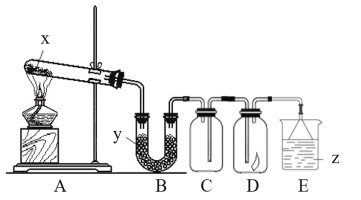
在如图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体d呈喷泉状喷出,最终几乎充满烧瓶。则a和b分别是
a(干燥气体)
b(液体)

A
NO
水
B
CO2
饱和NaHCO3溶液
C
Cl2
饱和NaCl溶液
D
NH3
1 mol·L-1盐酸
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
YBa2Cu8Ox(Y为钇元素)是磁悬浮列车中的重要超导材料,关于
的说法错误的是
A.属于金属元素 B.质子数与中子数之差为50
C.原子的核外电子数为39 D.
和
是两种不同的核素
难度: 简单查看答案及解析
-
X、Y、Z是三种短周期的主族元素,在周期表的位置如图,X原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )
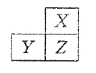
A.原子半径: Y >Z >X
B.元素气态氢化物的热稳定性:X < Z
C.Y和Z的最高价氧化物对应水化物均为强酸
D.X的最高正价为+6
难度: 中等查看答案及解析
-
下列关于F、Cl、Br、I性质的比较,不正确的是( )
A.它们的原子核外电子层数随核电荷数的增加而增多
B.被其他卤素单质从其卤化物中置换出来的可能性随核电荷数的增加而增大
C.它们的氢化物的稳定性随核电荷数的增加而增强
D.单质的颜色随核电荷数的增加而加深
难度: 中等查看答案及解析
-
关于化学键的各种叙述中,下列说法中正确的是( )
A.在离子化合物里,只存在离子键
B.共价化合物里,一定不存在离子键
C.非极性键只存在于双原子的单质分子里
D.由非金属元素组成的化合物中只存在共价键
难度: 简单查看答案及解析
-
下面是用电子式表示某些物质的形成过程,其中正确的是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
X+ 的核外电子数为18,则X元素在周期表中的位置是( )
A.第三周期第0族 B.第四周期第I A族
C.第三周期第I A族 D.第四周期第VI A族
难度: 简单查看答案及解析
-
下列说法中正确的是( )
A.ⅠA、ⅡA族元素的原子,其半径越大,越难失去电子
B.元素周期表中共有18个纵行,但仅有15个族
C.原子的核外电子层数等于该元素所在的周期数
D.原子最外层电子数等于该元素所在的族序数
难度: 简单查看答案及解析
-
原子序数为1-18的元素中,下列叙述正确的是( )
A.最外层只有4个电子的元素,一定是非金属元素
B.最外层只有2个电子的元素,一定是金属元素
C.最外层只有1个电子的元素,一定是金属元素
D.第0族元素的原子均为8电子稳定结构
难度: 中等查看答案及解析
-
下列物质中,属于共价化合物的是( )
A.CO2 B.NH4Cl C.CaCl2 D.NaCl
难度: 中等查看答案及解析
-
下列关于碱金属的说法中,正确的是( )
A.碱金属单质的密度都比水轻,投入水中都能浮在水面上
B.碱金属单质在氧气中燃烧,产物都是过氧化物
C.碱金属单质的熔沸点一般随着原子的电子层数的增多而升高
D.碱金属单质都是还原剂,其还原性随着核电荷数的增大而增强
难度: 中等查看答案及解析
-
在下列变化过程中,既有离子键被破坏又有共价键被破坏的是( )
A.将SO2通入水中 B.硫酸氢钠溶于水
C.将HCl通入水中 D.烧碱溶于水
难度: 简单查看答案及解析