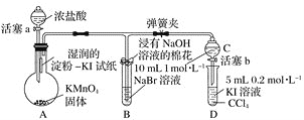
-
下列物质间发生化学反应,在不同条件下可制得不同产物的是( )
A. 钠和氧气 B. 钠和氯气
C. 镁和氧气 D. 钠和水
难度: 简单查看答案及解析
-
下列有关碱金属的说法不正确的是( )
A.均为ⅠA族元素,最外层均有1个电子
B.单质的还原性:Li>Na>K>Rb>Cs
C.碱性:LiOH<NaOH<KOH<RbOH<CsOH
D.由Li到Cs,核电荷数依次增加,电子层数、原子半径依次增大
难度: 中等查看答案及解析
-
下列关于ⅦA族元素的叙述正确的是
A.ⅦA族元素是同周期中原子半径最大的元素(惰性气体元素除外)
B.ⅦA族元素是同周期中非金属性最弱的元素
C.ⅦA族元素的最高正价都是+7价
D.ⅦA族元素其简单阴离子的核外电子层数等于该元素所在的周期数
难度: 中等查看答案及解析
-
共价键、离子键和范德华力是构成物质粒子间的不同作用方式,下列物质中,只含有上述一种作用的是( )
A.干冰 B.氯化钠 C.氢氧化钠 D.碘
难度: 中等查看答案及解析
-
关于原子核外电子排布的下列叙述正确的是( )
A.原子核外电子的能量按K、L、M、N电子层的顺序依次减小
B.原子核外次外层电子数不超过18个,倒数第三层不超过32个
C.某原子的K电子层为最外层,该电子层最多可容纳8个电子
D.某原子核外有三个电子层,其L层为次外层,最多可容纳18个电子
难度: 简单查看答案及解析
-
某元素的原子核外有3个电子层,最外层有4个电子,则该原子核内的质子数为( )
A.14 B.15 C.16 D.17
难度: 简单查看答案及解析
-
在11 g由D和18O组成的水中,含中子数为(NA表示阿伏加德罗常数)( )。
A.NA B.2NA C.6NA D.10NA
难度: 中等查看答案及解析
-
简单原子的原子结构可用下图来形象表示:
①
②
③
其中·表示质子或电子,°表示中子,则下列有关的叙述中,正确的是( )
A. ①②③为同素异形体 B. ①②③互为同位素
C. ①②③是三种化学性质不同的粒子 D. ①②③具有相同的质量数
难度: 中等查看答案及解析
-
下列物质中,属于共价化合物的是( )
A. Cl2 B. NH4Cl C. CH4 D. KOH
难度: 简单查看答案及解析
-
碳的一种同位素
可用于考古断代。下列关于
说法正确的是( )
A.质子数为14 B.中子数为8 C.质量数为6 D.核外电子数为8
难度: 简单查看答案及解析
-
X、Y、Z为原子序数依次增大的同周期的短周期元素。已知X、Y、Z三种原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水。下列判断正确的是( )
A.X、Y、Z三种元素的最高价氧化物的水化物可能有两种是强碱、一种是强酸
B.Z元素在第三周期第ⅥA族
C.Y、Z最高价氧化物对应的水化物间反应的离子方程式:H++ OH-=H2O
D.X、Y、Z三种元素有两种是金属,一种是非金属
难度: 中等查看答案及解析
-
关于离子化合物的判断不正确的是( )
A.无氧酸和含氧酸都不是离子化合物
B.氧化物都是离子化合物
C.碱和盐不一定都是离子化合物
D.ⅠA、ⅡA族金属和ⅥA、ⅦA族非金属形成的化合物都是离子化合物。
难度: 简单查看答案及解析
-
图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是
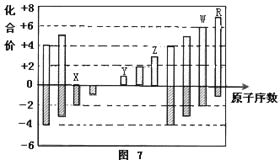 [
[A.X的氢化物形成的晶体中存在的最强作用力是分子间作用力
B.R的气态氢化物溶于水,离子键断裂
C.W的气态氢化物是离子化合物
D.Y和Z两者最高价氧化物对应的水化物能相互反应
难度: 中等查看答案及解析
-
关于铯及其化合物的以下各种说法中不正确的是( )
A.铝的金属性大于铯的金属性 B.氢氧化铯是一种强碱,比氢氧化钾的碱性强
C.铯的还原性比钠强,钠离子的氧化性比铯离子强 D.铯与水或酸溶液反应剧烈,都生成氢气
难度: 简单查看答案及解析
-
镉(Cd)是一种重金属元素,有多种核素,下列关于
Cd和
Cd说法正确的是( )
A.
Cd和
Cd属于两种不同的元素 B.
Cd和
Cd质量数相同
C.
Cd和
Cd是同一种核素 D.
Cd和
Cd互为同位素
难度: 简单查看答案及解析
-
锂是世界上最轻的金属,它属于碱金属的一种,下列说法不正确的是( )
A.锂位于元素周期表的第二周期第ⅠA族 B.钠离子比锂原子多一个电子层
C.锂离子与钠离子最外层电子数不相同 D.锂是碱金属中原子半径最小的原子
难度: 简单查看答案及解析
-
在元素周期表中前四周期的五种元素的位置关系如图所示。若B元素的核电荷数为Z,则五种元素的核电荷数之和为
A.5Z B.5Z+18
C.5Z+10 D.5Z+8
难度: 简单查看答案及解析
-
图中四条曲线分别表示ⅣA、ⅤA、ⅥA、ⅦA族元素的气态氢化物的沸点,其中表示ⅥA族元素气态氢化物沸点的是曲线( )
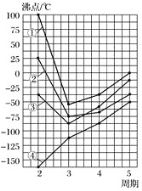
A.① B.② C.③ D.④
难度: 简单查看答案及解析
-
下列电子式或结构式错误的是
A.OH-的电子式
B.NH4Br的电子式
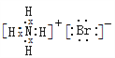
C.CCl4的电子式
D.CO2的结构式 O=C=O
难度: 简单查看答案及解析
-
下列叙述中,不正确的是
A. 共价化合物可能含有离子键
B. CCl4和NH3都是只含有极性键的共价化合物
C. Na2O2是含有非极性键的离子化合物
D. CaO和NaCl晶体熔化时要破坏离子键
难度: 中等查看答案及解析
-
关于卤素(用X表示)的下列叙述正确的是( )
A.卤素单质与水反应均可用X2+H2O=HXO+HX表示
B.HX都极易溶于水,它们的热稳定性随核电荷数增加而增强
C.卤素单质的颜色从F2→I2按相对分子质量增大而加深
D.X-的还原性依次为F-<Cl-<Br-<I-,因此相对分子质量小的卤素单质可将相对分子质量大的卤素从它的盐溶液里置换出来
难度: 简单查看答案及解析
-
主族元素在元素周期表中的位置,取决于元素原子的( )
A.相对原子质量和核电荷数 B.电子层数和中子数
C.电子层数和最外层电子数 D.电子层数和核外电子数
难度: 简单查看答案及解析
-
下列用电子式表示的化合物的形成过程正确的是
A.
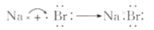 B.
B. 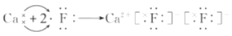
C.
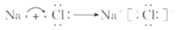 D.
D. 
难度: 中等查看答案及解析
-
俄罗斯科学家用含20个质子的钙的一种原子轰击含95个质子的镅原子,结果4次成功合成4个第115号元素的原子。这4个原子生成数微秒后衰变成第113号元素。下列有关叙述正确的是( )
A.115号元素在第六周期
B.113号元素在第七周期ⅢA族
C.115号和113号元素都是非金属元素
D.镅元素和115号元素不在同一周期
难度: 中等查看答案及解析