-
化学与生活密切相关,下列说法正确的是( )
A.SO2有漂白性,但用二氧化硫漂白过的草帽辫日久又变成黄色
B.高纯度的SiO2是制作电脑芯片的基础材料
C.酒精可以使蛋白质变性,酒精纯度越高杀菌效果越好
D.用食用油油炸可烹制美味的食品,食用油可反复加热使用
难度: 简单查看答案及解析
-
是阿伏伽德罗常数的值,下列说法正确的是( )
A.23 g Na在氧气中充分燃烧生成
,转移电子数为2
B.
的NaOH溶液中,含有
的数日为0.01
C.电子数为
的
分子的质量为1.6g
D.标准状况下,3.36 L的
中含有氧原子的数目为0.45
难度: 简单查看答案及解析
-
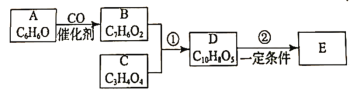
苯乙烯是中学化学常见的一种有机物,结构简式如图所示,以下说法正确的是( )
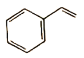
A.1 mol该物质与溴水充分反应,消耗4mol
B.该分子中最多有16个原子共平面
C.该分子中最多有7个C原子共平面
D.该分子中最多有4个C原子共直线
难度: 中等查看答案及解析
-
下列实验操作、现象与结论对应关系正确的是
选项
实验操作
实验现象
结论
A
向盛有稀
溶液的试管中加入
的
溶液
试管口出现红棕色气体
溶液中的
被
还原为
B
向某钠盐X溶液中加入盐酸,将产生的气体通入
酸化的
溶液中
有白色沉淀产生
反应生成的气体可能为
C
向滴加酚酞的氨水中加蒸馏水稀释
溶液红色变浅
溶液中所有离子的浓度均减小
D
用铂丝蘸取某溶液在酒精灯火焰上灼烧
直接观察,火焰呈黄色
溶液中的金属阳离子只有
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
近年来,新能源开发和环境保护问题日益引起人们的重视,新型电池是科学家们非常重视的研究方向。用吸附了
的碳纳米管等材料制作的二次电池的原理如图所示。下列说法正确的是( )
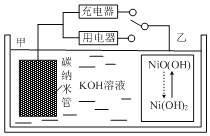
A.碳纳米管的作用只是吸附氢气
B.放电时,乙电极反应为
C.充电时,电池的甲电极与直流电源的正极相连放电
D.电池总反应为H2+2NiO(OH)
2Ni(OH)2
难度: 中等查看答案及解析
-
短周期主族元素a、b、c、d原子序数依次增大,b、c、d与a均可以形成二元化合物X、Y、Z,且X能分别与Y、Z发生化合反应生成离子化合物,c的L层电子数等于K层电子数和M层电子数之和,下列判断正确的是( )
A.简单阴离子半径:c<d
B.b元素可以形成一种常见的熔点很高的单质
C.氢化物稳定性:c>d
D.最高价氧化物对应水化物的酸性:b<d
难度: 中等查看答案及解析
-
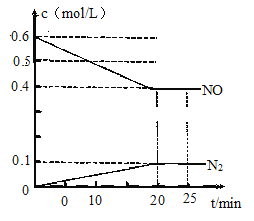
电解质溶液电导率越大导电能力越强,常温下用0.100 mol/L盐酸分别滴定10.00 mL浓度均为0.100 mol/L的NaOH溶液和氨水。利用传感器测得滴定过程中溶液的电导率如图所示,下列说法不正确的是( )
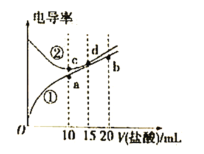
A.曲线②代表滴定氢氧化钠溶液的曲线
B.滴定氨水的过程应该选择甲基橙作为指示剂
C.b点溶液中:c(H+)<c(OH-)+c(NH4+)+c(NH3·H2O)
D.a、b、c、d四点的溶液中,水的电离程度最大的是a点
难度: 中等查看答案及解析
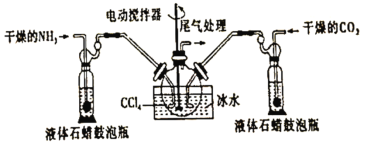
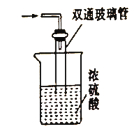
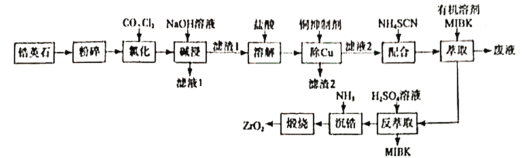
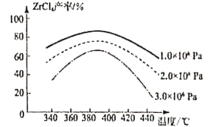
 )是工业上合成一种锅炉防腐剂的中间体,合成路线如下:
)是工业上合成一种锅炉防腐剂的中间体,合成路线如下: