-
化学为人类文明进步做出巨大贡献,下列涉及有关化学知识及分析错误的是( )
A.汉代烧制出“明如镜、声如磬”的瓷器,其主要原料为黏土
B.《医学入门》记载提纯铜绿的方法:“水洗净,细研水飞,去石澄清,慢火熬干。”文中涉及的操作方法是洗涤、溶解、过滤、灼烧
C.“春蚕到死丝方尽,蜡炬成灰泪始干”中描述“蜡炬成灰”过程中发生了氧化反应
D.《本草纲目》记载:“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”中的减是K2CO3
难度: 简单查看答案及解析
-
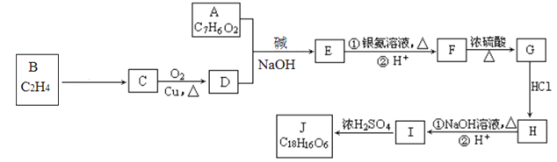
下列说法中错误的是( )
A.1mol有机物(
)与足量氢气反应,消耗氢气4mol
B.青蒿素(
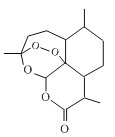 )具有强氧化性,有杀菌消毒作用
)具有强氧化性,有杀菌消毒作用C.二苯并呋哺(
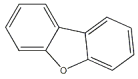 ),其一氯代物有4种
),其一氯代物有4种D.乙烷和Cl2的反应与油脂的硬化反应类型相同
难度: 简单查看答案及解析
-
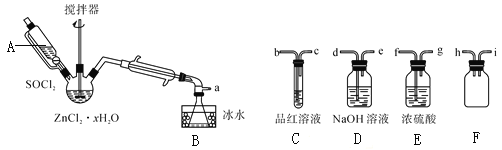
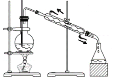
利用下列实验所选择的装置或仪器(夹持装置已略去)不能达到实验目的的是( )
A.利用图装置制备并收集乙酸乙酯

B.利用图装置探究SO2的氧化性和漂白性

C.利用图装置收集氨气并进行尾气吸收
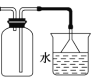
D.利用图装置从苯和溴苯的混合溶液中分离出溴苯
难度: 简单查看答案及解析
-
NA表示阿伏加德罗常数的数值,下列说法正确的是( )
A.将标况下22.4LCl2通入水中,HClO、Cl-、ClO-粒子数之和为2NA
B.1.0molCH4与Cl2在光照下反应生成的CH3Cl分子数为NA
C.某温度下纯水的pH=6,该温度下10L pH=11的NaOH溶液中含OH-的数目为NA
D.常温常压下,20gD218O分子中所含质子数为10NA
难度: 中等查看答案及解析
-
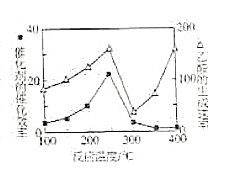
X、Y、Z、W为原子序数依次增大的四种短周期主族元素,W原子是同周期元素中原子半径最小的主族元素。已知A、B、C、D、E为上述四种元素中的两种或三种所组成的5种化合物间的转化关系如右图所示。A的相对分子质量为28,B分子中含有18个电子。下列有关说法错误的是( )
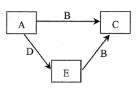
A.由W、Z、X三种元素组成的化合物一定是强酸
B.E能与金属钠反应产生气体
C.化合物D中含有极性键
D.最高价氧化物对应的水化物的酸性W最强
难度: 中等查看答案及解析
-
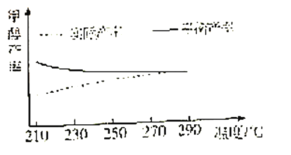
科学家研究利用如图装置对天然气进行脱硫,将硫由化合态转化成游离态,减少对环境的污染。已知甲、乙池中发生的反应如图所示。下列说法正确的是( )

A.全氟磺酸膜为阳离子交换膜,H+从甲池移向乙池,乙池溶液的pH变小
B.电路中每转移2mol电子,甲池溶液质量增加32g
C.N型半导体为负极,发生的电极反应式为H2S+I3-=3I-+S↓+2H+
D.甲池中碳棒上发生的电极反应为AQ+2H++2e-=H2AQ
难度: 困难查看答案及解析
-
25℃时,下列两种酸的电离平衡常数如下:
化学式
H2CO3
HClO
电离平衡常数
K1=4.3×10-7K2=5.6×10-11
3.0×10-8
常温下,将0.1mol·L-1的HClO溶液与0.1mol·L-1的Na2CO3溶液等体积混合,所得溶液中各种离子浓度关系错误的是( )
A.c(Na+)>c(HCO3-)>c(ClO-)>c(OH-)>c(H+)
B.c(Na+)>c(ClO-)>c(HCO3-)>c(OH-)>c(H+)
C.c(Na+)+c(H+)=c(ClO-)+c(HCO3-)+2c(CO32-)+c(OH-)
D.c(Na+)=c(HClO)+c(ClO-)+c(HCO3-)+c(H2CO3)+c(CO32-)
难度: 中等查看答案及解析