-
室温下,有两种溶液:①0.01 mol·L-1 NH3·H2O溶液 ②0.01 mol·L-1 NH4Cl溶液,下列操作可以使两种溶液中c(NH4+)都增大的是( )
A.加入少量H2O B.加入少量NaOH固体
C.通入少量HCl气体 D.升高温度
难度: 简单查看答案及解析
-
相同物质的量浓度的NaCN和NaClO相比,NaCN溶液的pH较大,则下列关于同温、同体积、同浓度的HCN和HClO溶液的说法中正确的是( )
A.酸的强弱:HCN>HClO
B.pH:HClO>HCN
C.与NaOH恰好完全反应时,消耗NaOH的物质的量:HClO>HCN
D.酸根离子浓度:c(CN-)<c(ClO-)
难度: 中等查看答案及解析
-
下表中物质的分类组合完全正确的是
选项
A
B
C
D
强电解质
KNO3
H2SO4
BaSO4
HClO4
弱电解质
HF
CaCO3
HClO
NH3
非电解质
SO2
金属Al
H2O
C2H5OH
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列说法正确的是
A.水库的钢闸门接直流电源的正极,可以减缓闸门的腐蚀
B.加入少量硫酸铜可加快锌与稀硫酸的反应速率,说明Cu2+具有催化作用
C.H2O2分解产生标准状况下22.4 L O2,理论上转移电子数约为4×6.02×1023
D.常温下pH=3的盐酸与pH=11的某碱溶液等体积混合,若溶液呈碱性,该碱为弱碱
难度: 中等查看答案及解析
-
下列事实中,能说明HNO2是弱电解质的是
A.HNO2溶液用水稀释后,H+浓度下降
B.HNO2溶液的导电性比盐酸弱
C.HNO2溶液不与氯化钠反应
D.0. lmol•L-1的HNO2溶液的c(H+)= l0-2mol/L
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.向稀醋酸溶液中加入少量醋酸钠固体,醋酸的电离程度增大
B.电镀时,通常把待镀金属制品作阳极,镀层金属作阴极
C.常温下,2NO2(g)=2NO(g)+O2(g)不能自发进行,则该反应的ΔH>0
D.工业通过反应“Na(l)+KCl(l)
NaCl(l)+K(g)”冶炼钾、说明钠的金属性强于钾
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中可能大量共存的是( )
A.含有大量ClO-的溶液:Na+、OH-、I-、SO32-
B.使pH试纸变蓝的溶液:NH4+、K+、S2-、CO32-
C.pH=12的溶液:K+、Na+、CH3COO-、Br-
D.c(Al3+)=0.1 mol·L-1的溶液:Na+、Cl-、CO32-、NO3-
难度: 中等查看答案及解析
-
常温下,关于物质的量浓度均为0.1 mol·L-1的盐酸、硫酸、醋酸的说法不正确的是( )
A.等体积的三种酸中加入等体积、等物质的量浓度的NaOH,反应后溶液的pH:醋酸>盐酸>硫酸
B.与等物质的量的NaOH溶液反应,消耗三种酸的体积:硫酸>盐酸=醋酸
C.等物质的量浓度的NaHCO3溶液与三种酸反应,产生气体的起始速率:硫酸>盐酸>醋酸
D.三种溶液的pH:醋酸>盐酸>硫酸
难度: 中等查看答案及解析
-
下列有关电解质溶液的说法正确的是( )
A.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中
增大
C.向盐酸中加入氨水至中性,溶液中
>1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中
不变
难度: 中等查看答案及解析
-
已知BaCO3和BaSO4均为难溶电解质,其溶度积分别为Ksp(BaCO3)=5.1×10-9 mol2·L-2,Ksp(BaSO4)=1.1×10-10mol2·L-2,则下列说法中正确的是
A.BaSO4可做钡餐而BaCO3不能是因为Ksp(BaSO4)<Ksp(BaCO3)
B.在制腈纶纤维的1 L溶液中含SO42-为1.0×10-3mol,则加入0.01 mol BaCl2不能使SO42-完全沉淀
C.在清理有关仪器的BaSO4沉淀时,常加入饱和Na2CO3溶液,使BaSO4转化为BaCO3再用酸处理
D.用稀H2SO4洗涤BaSO4效果比用水好,BaCO3也能用此法处理
难度: 中等查看答案及解析
-
下列物质的水溶液能导电,但属于非电解质的是( )
A.CO2 B.BaSO4 C.NaCl D.CH3COOH
难度: 简单查看答案及解析
-
在下列各溶液中,离子一定能大量共存的是( )
A.室温下,pH=13的溶液中:K+、Al3+、Cl-、SO42-
B.含有1mol·L-1Fe3+的溶液中:K+、Mg2+、OH-、NO3-
C.由水电离的c(H+)=10-12 mol·L-1的溶液中,K+、Na+、Cl-、SO42-
D.室温下,pH=1的溶液中:Na+、HCO3-、NO3-、SO42-
难度: 中等查看答案及解析
-
25℃时,下列各组溶液等体积混合后,所得溶液的pH最大的是( )
A.pH=1的盐酸与pH=13的Ba(OH)2溶液
B.0.1mol·L-1H2SO4溶液与0.2mol·L-1氨水
C.pH=1的CH3COOH溶液与pH=13的NaOH溶液
D.0.1mol·L-1CH3COOH溶液与0.1 mol·L-1NaOH溶液
难度: 中等查看答案及解析
-
为了配制
的浓度与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入
①适量的HCl ②适量的NaCl ③适量的氨水 ④适量的NaOH
A.①② B.③ C.③④ D.④
难度: 中等查看答案及解析
-
对于难溶盐MX,其饱和溶液中M+和X-的物质的量浓度之间存在关系等式Ksp= c(M+)·c(X-)。现将足量的AgCl分别放入下列物质中,AgCl的溶解度最大的是( )
A.40 mL 0.03 mol·L-1HCl溶液 B.20 mL 0.02 mol·L-1KCl溶液
C.30 mL 0.02 mol·L-1CaCl2溶液 D.50 mL 0.05 mol·L-1AgNO3溶液
难度: 中等查看答案及解析
-
一定温度下,某NaCl稀溶液中[H+]为1×10-6 mol·L-1,下列说法正确的是
A.该NaCl溶液显酸性 B.该NaCl溶液中Kw=1×10-14
C.该NaCl溶液中Kw=1×10-12 D.该NaCl溶液稀释10倍后pH=7
难度: 中等查看答案及解析
-
一定温度下,水溶液中H+的浓度变化曲线如图所示,下列说法正确的是( )
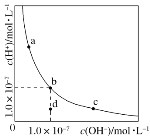
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
难度: 中等查看答案及解析