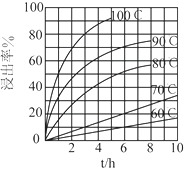
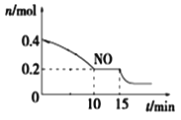
-
下列指定反应的离子方程式正确的是
A.将铜插入稀硝酸中:Cu+4H++2NO3–=Cu2++2NO2↑+H2O
B.向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe=2Fe2+
C.向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
D.向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+
难度: 简单查看答案及解析
-
化学与生产、生活密切相关,下列说法不正确的是
A.碳酸钠俗称纯碱,可用于去除餐具的油污
B.盐碱地不利于作物生长,可通过施加生石灰进行改良
C.用K2FeO4处理自来水,既可杀菌消毒又可除去悬浮杂质
D.生产医用口罩的聚丙烯树脂原料属于合成有机高分子材料
难度: 简单查看答案及解析
-
设NA表示阿伏伽德罗常数的值。下列说法正确的是
A.由H218O与D216O组成的2.0g物质中所含中子、电子数均为NA
B.0.1molFe分别与足量的盐酸和氯气反应,转移的电子数均为0.2NA
C.0.1molAl与足量NaOH溶液反应,生成氢分子数为0.3NA
D.25℃,将0.1molCH3COONa加入稀醋酸至溶液呈中性时,溶液中CH3COO-数小于0.1NA
难度: 中等查看答案及解析
-
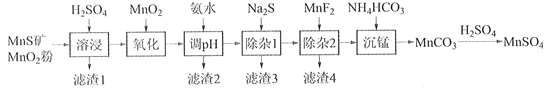
氨是制造化肥的重要原料,如图为工业合成氨的流程图。下列有关说法错误的是

A.工业上制氮气一般用分离液态空气法
B.步骤②、③、④、⑤均有利于提高反应物的平衡转化率
C.步骤①中“净化”N2、H2混合气体可以防止催化剂中毒
D.步骤③中温度选择500℃,主要是考虑催化剂的活性
难度: 中等查看答案及解析
-
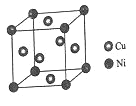
已知M是短周期金属元素,X和Y是短周期非金属元素,且X、M、Y的原子序数依次增大。三者组成的物质M3XY(可视为M2X∙MY)是一种良好的离子导体。研究者在常压下利用下列反应合成M3XY: 2M + 2MXA +2MY==2M3XY +A2。其中常温常压下A2是无色无味气体,已知上述反应中消耗0.92 g M的单质可得到标准状况下448 mL的A2。下列有关说法正确的是
A.简单离子半径:Y>M>X
B.简单氢化物的沸点:X小于Y
C.MXA是共价化合物
D.M3XY溶于水后溶液呈碱性
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数值。关于常温下pH=2的H3PO4溶液,下列说法正确的是
A. 每升溶液中的H+数目为0.02NA
B. c(H+)= c(
)+2c(
)+3c(
)+ c(OH−)
C. 加水稀释使电离度增大,溶液pH减小
D. 加入NaH2PO4固体,溶液酸性增强
难度: 简单查看答案及解析
-
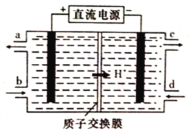
[2017新课标Ⅰ]支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是
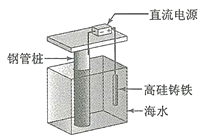
A. 通入保护电流使钢管桩表面腐蚀电流接近于零
B. 通电后外电路电子被强制从高硅铸铁流向钢管桩
C. 高硅铸铁的作用是作为损耗阳极材料和传递电流
D. 通入的保护电流应该根据环境条件变化进行调整
难度: 困难查看答案及解析