-
下列有关说法正确的是( )
A.医用酒精和84消毒液(NaClO溶液)混合使用能增强它们的消毒效果
B.气溶胶被认为可以传播新冠病毒,它是气体分散质分散到液体分散剂中的一种胶体
C.“熔喷布”可用于制作口罩,生产“熔喷布”的主要原料是聚丙烯,它属于混合物
D.疫情期间可以多吃富含纤维素的食物,它们在人体内都可以通过水解反应提供能量
难度: 简单查看答案及解析
-
下列物质中分子间存在大量氢键的是( )
A.CH3CH2OH(l) B.CH3—O—CH3(l) C.C2H6(g) D.NH3(g)
难度: 简单查看答案及解析
-
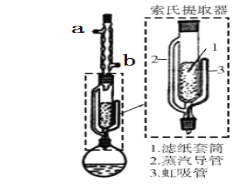
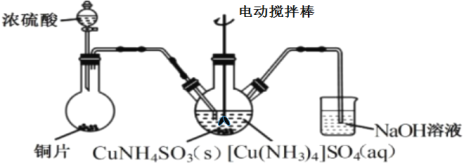
下列有关实验原理、装置、操作或结论的描述正确的是( )
A.图反应一段时间后试管中液面会下降
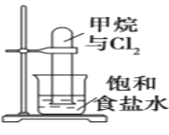
B.图装置可用于分离乙醇和乙酸乙酯的混合液
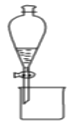
C.图装置可用于实验室制乙炔
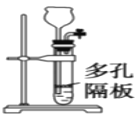
D.图教材重结晶法提纯苯甲酸的实验中,主要步骤依次为:加热溶解→趁热过滤→冷却结晶→过滤
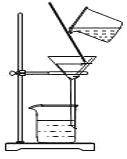
难度: 中等查看答案及解析
-
下列各组离子能在指定溶液中大量共存的是( )
A.透明溶液中:K+、Al3+、HCO3-、SO42-
B.水电离的c(H+)=10-12mol/L的溶液中:Na+、Fe2+、NO3-、Cl-
C.强碱性溶液中:K+、Na+、Cl-、CH3COO-
D.c(Fe3+)=1mol/L的溶液中:NH4+、K+、SCN-、SO42-
难度: 简单查看答案及解析
-
化合物1,1—二环丙基乙烯
是重要的医药中间体。下列有关该化合物的说法错误的是( )
A.分子中所有碳原子不可能共平面
B.该化合物分子式为C8H14
C.核磁共振氢谱有3种峰
D.该化合物一定条件下能发生取代反应、加成反应和氧化反应
难度: 简单查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增加。A、B、C、D均是由这些元素组成的二元化合物,甲是Y的固体单质,常温下0.05mol/L乙溶液的pH为1。A是无色气体,是主要的大气污染物之一,上述物质的转化关系如图所示。下列说法错误的是( )
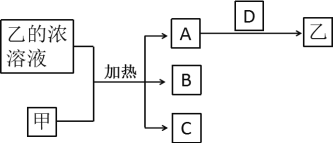
A.原子半径:X<Z<W
B.D中存在极性键和非极性键
C.最高价含氧酸的酸性:W>Y
D.化合物YZW中键角为120°
难度: 中等查看答案及解析
-
酞菁钴被广泛应用于光电材料、光动力学光敏材料等方面。酞菁钴(II)结构如图所示(Co均形成单键,部分化学键未画明)。下列说法错误的是( )
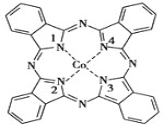
A.酞菁钴(II)中三种非金属元素的电负性大小顺序为N>C>H
B.酞菁钴(II)中碳原子的杂化方式只有sp2杂化
C.1号和3号N原子的VSEPR模型均为平面三角形
D.2号和4号N原子与Co(Ⅱ)是通过配位键结合
难度: 中等查看答案及解析
-
工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)
Si(s)+4HCl(g),有关化学键的键能数据如表所示:
化学键
Si—Cl
H—H
H—Cl
Si—Si
Si—C
键能kJ/mol
360
436
431
176
347
下列说法正确的是( )
A.反应中的能量变化与物质的状态无关
B.像这样需要加热才能进行的反应都是吸热反应
C.晶体硅比SiC更稳定
D.该反应中每生成1molSi(s)吸收的能量为236kJ
难度: 中等查看答案及解析
-
水煤气变换反应是重要的化工过程,反应方程式为:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH。我国科学家在这一变换中利用双功能催化剂突破了低温下高转化率与高反应速率不能兼得的难题。反应历程如图所示:
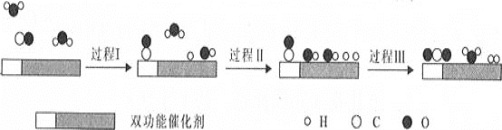
下列说法错误的是( )
A.该反应ΔH<0
B.根据历程图示过程Ⅰ为吸热过程、过程Ⅲ为放热过程
C.整个历程中两个H2O分子都参与了反应
D.使用双功能催化剂降低了水煤气变换反应的ΔH
难度: 中等查看答案及解析
-
我国科学家设计了一种太阳能驱动的H2S分解装置,工作原理如图所示。下列叙述正确的是( )
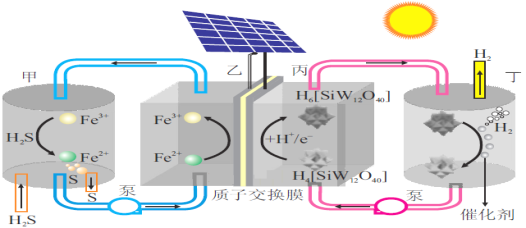
A.甲区发生反应的离子方程式为:2Fe3++S2-=2Fe2++S↓
B.理论上每生成1molS时,H+由质子交换膜右侧向左侧移动的物质的量为2mol
C.丙区发生的电极反应为:H4[SiW12O40]+2e-+2H+=H6[SiW12O40]
D.丁区H6[SiW12O40]在催化剂表面发生电化学反应生成H4[SiW12O40]和H2
难度: 困难查看答案及解析
-
某无色溶液中可能含有Ba2+、Fe3+、Na+、K+、NH4+、SO42-、SO32-、Cl-、Br-、CO32-中的若干种,离子浓度都为0.1mol/L.往该溶液中加入BaCl2和过量的盐酸,无白色沉淀生成。另取少量原溶液,设计并完成如下实验。下列判断正确的是( )
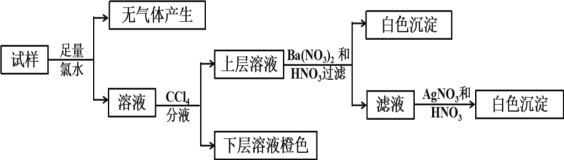
A.Ba2+、Fe3+、SO42-、CO32-肯定不存在,Na+、K+肯定存在
B.原溶液肯定不含SO42-和SO32-
C.若步骤中Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,对溶液中离子的判断有影响
D.是否含NH4+需另做实验判断
难度: 中等查看答案及解析
-
轻质氧化镁和硼酸(H3BO3)都是重要的化工原料,可采用硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸和轻质氧化镁,其工艺流程如图:
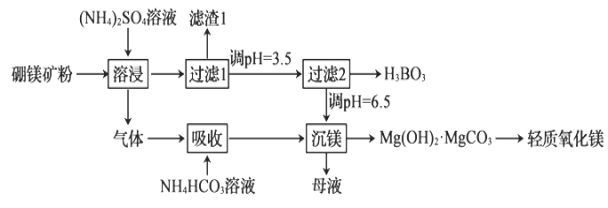
下列叙述错误的是( )
A.Fe2O3、Al2O3都不能溶于(NH4)2SO4溶液
B.进入“吸收”工序中的气体为NH3
C.若“过滤2”时调节溶液的碱性越强得到的硼酸越多
D.“沉镁”中得到的母液经加热后可返回“溶浸”工序循环使用
难度: 困难查看答案及解析
-
电渗析法是海水淡化的常用方法,某地海水中主要离子的含量如下表,现利用“电渗析法”进行淡化,技术原理如图所示(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列说法错误的是( )

A.淡化过程中易在甲室形成水垢
B.淡化过程中戊室的电极反应式为:2Cl--2e-=Cl2↑
C.淡化过程中乙室和丁室中部分离子的浓度减小,淡水的出口为a、c
D.当甲室收集到标准状况下11.2L气体时,通过甲室阳膜的离子的物质的量一定为1mol
难度: 困难查看答案及解析



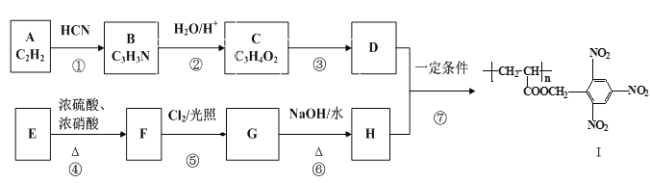 已知以下信息:
已知以下信息: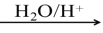 RCOOH
RCOOH