-
已知 A、B、C、D、E 是短周期中原子序数依次增大的五种元素,A、B 形成的简单化合物常用作制冷剂,D 原子最外层电子数与最内层电子数相等,化合物 DC 中两种离子的电子层结构相同,A、B、C、D 的原子序数之和是 E 的两倍。下列说法正确的是( )
A.原子半径:C>B>A
B.气态氢化物的热稳定性:E>C
C.最高价氧化对应的水化物的酸性:B>E
D.化合物 DC 与 EC2 中化学键类型相同
难度: 简单查看答案及解析
-
中国传统文化对人类文明贡献巨大,古代文献中记载了很多化学研究成果。下列古诗文对应的化学知识正确的是
选项
古诗文
化学知识
A
《华阳国志》中记载:“取井火煮之,一斛水得五斗盐”
我国古代已利用天然气煮盐
B
《本草纲目拾遗》中对强水的记载:“性最烈,能蚀五金,其水甚强,五金八石皆能穿第,惟玻璃可盛”
“强水”是指氢氟酸
C
《天工开物》中记载:“世间丝、麻、裘、褐皆具素质”
文中“丝、麻、裘”的主要成分都是蛋白质
D
《抱朴子》中记载:“丹砂(HgS)烧之成水银,积变又还成丹砂”
文中描述的是升华和凝华过程
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值。硫化钠广泛应用于冶金染料、皮革、电镀等工业。硫化钠的一种制备方法是Na2SO4+2C
Na2S+2CO2↑。下列说法正确的是
A.4.2g14C原子含中子数目为1.8NA
B.1L0.1mol/LNa2S溶液中含阴离子的数目小于0.1NA
C.该反应中,若生成1mol氧化产物,转移电子数目为4NA
D.常温下2.24LCO2中共用电子对数目为0.4NA
难度: 中等查看答案及解析
-
下列实验的现象与结论相对应的是
A
B
C
D
实验
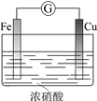

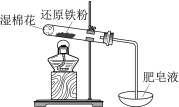
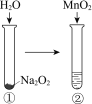
现象
电流计指针向右偏(电子由Fe转移到Cu),片刻后向左偏
加热一段时间后溶液蓝色褪去
加热,肥皂液中产生无色气泡
①和②中均迅速产生大量气泡
结论
铁片作负极,片刻后铜片作负极
淀粉在酸性条件下水解,产物是葡萄糖
铁粉与水蒸气反应生成H2
MnO2一定是②中反应的催化剂
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
Fe3O4中含有Fe(Ⅱ)、Fe(Ⅲ),以Fe3O4/Pd为催化材料,可实现用H2消除酸性废水中的致癌物NO2-,其反应过程如图所示。下列说法正确的是( )
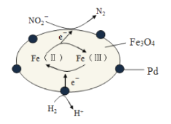
A.Pd作正极
B.Fe(Ⅱ)与Fe(Ⅲ)的相互转化起到了传递电子的作用
C.反应过程中NO2-被Fe(Ⅱ)氧化为N2
D.用该法处理后水体的pH降低
难度: 中等查看答案及解析
-
已知高能锂电池的总反应式为:2Li+FeS=Fe+Li2S[LiPF6SO(CH3)2为电解质],用该电池为电源进行如图的电解实验,电解一段时间测得甲池产生标准状况下H24.48L。下列有关叙述不正确的是
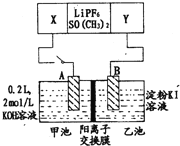
A.从隔膜中通过的离子数目为0.4NA
B.若电解过程体积变化忽略不计,则电解后甲池中溶液浓度为4mol/L
C.A电极为阳极
D.电源正极反应式为:FeS+2Li++2e-=Fe+Li2S
难度: 中等查看答案及解析
-
在25℃时,将1.0L c mol·L-1 CH3COOH溶液与0.1mol NaOH固体混合,使之充分反应。然后向该混合溶液中通入HCl气体或加入NaOH固体(忽略体积和温度变化),溶液pH随通入(或加入)物质的物质的量的变化如图所示。下列叙述错误的是( )
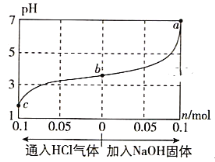
A. 水的电离程度:a>b>c
B. c点对应的混合溶液中:c(CH3COOH)>c(Na+)>c(OH-)
C. a点对应的混合溶液中:c(Na+)=c(CH3COO-)
D. 该温度下,CH3COOH的电离平衡常数
难度: 中等查看答案及解析
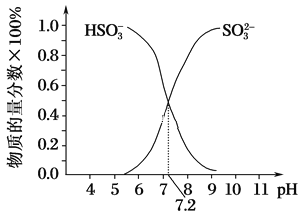
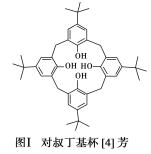
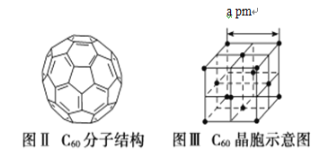
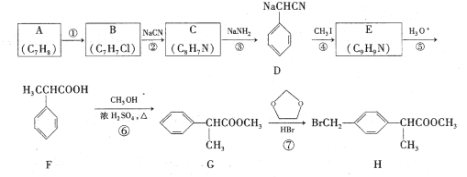
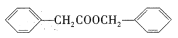 的合成路线。_______
的合成路线。_______