-
下列实验中,不能观察到明显变化的是( )
A.把一段打磨过的镁带放入少量冷水中
B.把Cl2通入FeCl2溶液中
C.把绿豆大的钾投入少量水中
D.把溴水滴加到淀粉KI溶液中
难度: 简单查看答案及解析
-
抗击新冠疫情,当前的重要工作是“外防输入,内防反弹”。下列说法不正确的是
A.可直接注射或饮用大量84消毒液杀灭人体内新冠病毒
B.测量体温、保持适当社交距离是防控新冠肺炎的重要举措
C.佩戴医用口罩、KN95口罩可有效降低感染新冠肺炎风险
D.新冠病毒溯源本身是科学问题,也是一项科学难题
难度: 简单查看答案及解析
-
能源是现代物质文明的原动力。下列说法正确的是
A.人体运动所消耗的能量与化学反应无关 B.煤、石油、天然气是可再生的能源
C.化学反应必然伴随发生能量变化 D.生物质能的缺点是严重污染环境
难度: 简单查看答案及解析
-
化学用语的书写和使用应符合规范要求。下列化学用语不正确的是
A.含10个中子的氧原子的核素符号:
B.氯化氢的结构式:H-Cl
C.S2-离子的结构示意图:
D.二氧化碳的电子式:
难度: 简单查看答案及解析
-
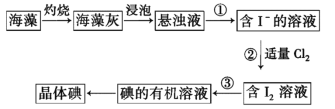
下列关于F、Cl、Br、I性质的比较,正确的是
A.它们的原子核外最外层电子数随核电荷增加而增多
B.被其他卤素单质从其卤化物中置换出来的可能性随核电荷数的增加而增大
C.它们的氢化物的稳定性随核电荷数的增加而增强
D.单质的熔沸点随核电荷数的增加而降低
难度: 简单查看答案及解析
-
下列各组材料中,能够组成原电池的是
A
B
C
D
两极材料
石墨、石墨
Zn片、Cu片
石墨、Cu片
Zn片、Cu片
插入溶液
H2SO4溶液
酒精
稀盐酸
CuSO4溶液
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应后,反应速率最快和最慢的容器编号分别是
容器编号
温度
SO2的物质的量
O2的物质的量
催化剂
甲
500 ℃
10 mol
5 mol
-
乙
500 ℃
10 mol
5 mol
V2O5
丙
500 ℃
8 mol
5 mol
-
丁
450 ℃
8 mol
5 mol
-
A.甲、乙 B.甲、丙 C.乙、丁 D.丙、丁
难度: 简单查看答案及解析
-
下列有关氢化物的叙述中不正确的是
A.沸点:H2S > H2O B.还原性:HI > HCl
C.稳定性:CH4 > SiH4 D.NH3的水溶液显碱性
难度: 简单查看答案及解析
-
下列反应中,既属于氧化还原反应同时又属于吸热反应的是
A.CaCO3的分解反应 B.灼热的炭与CO2反应
C.铝与稀盐酸反应 D.稀H2SO4与稀KOH的反应
难度: 简单查看答案及解析
-
下列实验的现象及对应的结论均正确的是
实验操作
实验现象
结论
A
打磨光的铝条和6 mol/L的盐酸反应
铝条表面有气泡产生
该反应是放热反应
B
Ba(OH)2·8H2O与NH4Cl固体混合搅拌
有刺激性气味的气体产生
该反应是吸热反应
C
钠和镁分别与冷水反应
金属钠剧烈反应,镁缓慢反应
钠的金属性比镁的金属性强
D
Cu、Zn和稀硫酸构成原电池
Cu电极表面有气泡产生
Cu失去电子被氧化
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
已知:在密闭容器中进行的可逆反应3H2 + N2
2NH3,其正反应是放热反应。下列有关叙述正确的是
A.使用催化剂是为了加快反应速率,提高生产效率
B.升高温度可加快逆反应速率,但不能改变正反应速率
C.N2过量时,H2可100%转化为NH3
D.达到平衡时,H2与NH3的浓度均不再改变,此时v正=v逆=0
难度: 中等查看答案及解析
-
5月5日,长征五号B火箭成功从海南文昌发射升空,为我国搭建空间站的计划拉开了序幕。以30% KOH溶液为电解质溶液的氢氧燃料电池可用于空间站中提供电能,其电极反应如下:2H2 + 4OH- - 4e- = 4H2O ,O2 + 2H2O + 4e- = 4OH- 。据此判断,下列说法中正确的是
A.燃料电池属二次电池
B.供电时产生无污染的水,属于环境友好电池
C.燃料电池的能量转化率可达100%
D.H2在正极发生氧化反应
难度: 中等查看答案及解析
-
硒(Se)是人体必需的微量元素,在元素周期表中的位置如图所示。下列关于硒元素的叙述正确的是
A.硒元素位于元素周期表第四周期第IVA族
B.H2Se比HBr稳定
C.硒的非金属性比S弱
D.硒最高价氧化物对应水化物的化学式为H2SeO3
难度: 中等查看答案及解析
-
在一定条件下,将AB和B2充入一密闭容器,发生2AB(g) + B2(g)⇌2AB2(g)的反应。下列说法中不正确的是
A.随着反应的进行,正反应速率逐渐减小,反应物的转化率也逐渐减小
B.反应开始时,正反应速率最大,逆反应速率为零
C.随着反应的进行,逆反应速率逐渐增大,最后不变
D.随着反应的进行,正反应速率逐渐减小,最后不变
难度: 中等查看答案及解析
-
根据元素周期表和元素周期律分析下面的推断,其中正确的是
A.铍(Be)的原子失电子能力比镁强
B.砹(At)的氢化物很稳定
C.氢氧化铊[Tl(OH)3]具有两性
D.氢氧化锶[Sr(OH)2]比氢氧化钙的碱性强
难度: 中等查看答案及解析
-
雷雨天闪电时空气中有臭氧(O3)生成,下列说法不正确的是
A.O2和O3互为同素异形体
B.同温同压下,等体积的O2和O3具有相同的原子数
C.O2和O3的相互转化是化学变化
D.氧气比臭氧稳定
难度: 中等查看答案及解析
-
已知:5X- + XO3-+ 6H+=3X2 + 3H2O,下列关于短周期元素X在周期表中的位置的说法正确的是
A.第二周期VA族 B.第二周期VIIA族
C.第三周期VA族 D.第三周期VIIA族
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.标准状况下,2.24升水的分子数目为0.1 NA
B.1.9gHDO中的电子数目为1.1 NA
C.铜锌原电池中,转移0.2mol电子时,铜电极上产生2.24L气体
D.标准状况下,2.24L H2和HCl的混合气体中,共用电子对数目为0.1NA
难度: 中等查看答案及解析
-
元素X、Y、Z的原子序数之和为36;X、Y在同一周期;X+与Z2-具有相同的核外电子层结构。则下列相关叙述不正确的是
A.原子半径X>Y,离子半径X+>Z2-
B.同周期元素中X的非金属性最强
C.同主族元素中Z的氢化物稳定性最强
D.同周期元素中Y的最高价氧化物对应水化物的酸性最强
难度: 中等查看答案及解析
-
海冰是海水冻结而成的咸水冰,海水冻结时,部分来不及流走的盐分(设以NaCl为主)以卤汁的形式包裹在冰晶之间,形成“盐泡”,其大致结构如图所示。若海冰的冰龄达到1年以上,则融化后的水为淡水。用NA表示阿伏加德罗常数的值,设冰的密度为0.9g/cm3。下列叙述正确的是
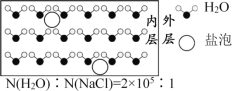
A.海冰内层“盐泡”越少,密度越大
B.海冰冰龄越短,内层的“盐泡”越少
C.冰的密度比水小是因为在固态冰中水分子间以氢键结合,排列更规整
D.每含1mol H2O的海冰内就有2×105 NA个NaCl分子
难度: 中等查看答案及解析