-
下列说法中正确的是 ( )
A.生活中,牛油比大豆油的抗氧化性更强一些
B.做衣服的棉、麻、蚕丝的成分都是纤维素
C.冬季应常用热碱水清洗手上的污垢
D.酒精、汽油、NH4NO3均是易燃性危险化学品
难度: 简单查看答案及解析
-
某饱和链烃的含氧衍生物X具有如下性质:X+H2O
Y+Z,其中Y的摩尔质量为46g/mol。若X分子中有6个碳原子,则X的结构(不考虑立体结构)最多有( )
A.10种 B.8种 C.7种 D.6种
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列叙述中正确的是 ( )
A.3.2gO2与钠完全反应后,生成的阴离子的总数为0.2NA
B.0.1mol氯气完全溶于水后,溶液中Cl−、HClO数目之和为0.2NA
C.7.1g氯气与2.24L氯气中氯分子数目均为0.1NA
D.甘油(C3H8O3)与丙醇的混合物共0.1mol完全燃烧时生成的水分子数目为0.4NA
难度: 中等查看答案及解析
-
某溶液X中可能含有大量下列离子中的若干种:Fe3+、Na+、Ba2+、I-、H+、CO32-,下列有关X的假设与结论的分析中正确的是( )
假设
溶液成分
A
X遇酚酞变红色
溶质一定是Na2CO3
B
加入氨水后得到红褐色沉淀
一定不含I-
C
若加入铝粉后有Al3+生成
一定含有H+
D
若加入淀粉后溶液不显蓝色
一定不含有I-、一定含有CO32-
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
W、X、Y、Z是原子序数依次增大的四种短周期主族元素,W与Z的最外层电子数目之和等于X、Y最外层电子数目之和。已知X、Y同主族且二者之间能形成两种常见的易与碱反应的化合物,下列说法中正确的是 ( )
A.离子半径:Z>Y>W>X
B.Z的单质能与Y的氢化物发生置换反应
C.W、Y、Z形成的含氧酸均是强酸
D.X元素的氢化物中只存在一种类型的共价键
难度: 中等查看答案及解析
-
下列有关实验装置、操作中不能实现相应实验目的的是 ( )
A
B
C
D
装
置
目的
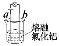
证明AlCl3是共价化合物
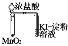
证明在NaOH的乙醇溶液中加热溴乙烷时有乙烯生成
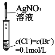
证明氯气氧化性强于I2
比较Ksp(AgCl)、Ksp(AgBr)的相对大小
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
新型微生物电池可利用生活垃圾发电,其工作原理如图所示,下列有关说法中错误的是( )
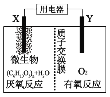
A.X电极的反应式为:(C6H10O5)n+7nH2O-24ne-=6nCO2↑+24nH+
B.每消耗1molO2时会有4mol质子通过质子交换膜
C.工作时外电路电流由负极流向正极
D.微生物所起作用与催化剂相当
难度: 中等查看答案及解析
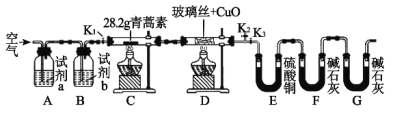

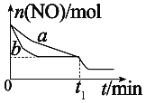
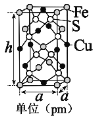
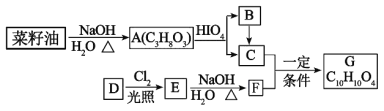
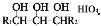 R1CHO+HCOOH+R2CHO(R1、R2是烃基或者氢原子)。
R1CHO+HCOOH+R2CHO(R1、R2是烃基或者氢原子)。