-
材料与化学密切相关,表中对应关系不正确的是
材料
主要化学成分
A.
陶瓷餐具
硅酸盐
B.
计算机芯片
晶体硅
C.
合金钢
铁碳铬硅等合金
D.
金刚砂
二氧化硅
难度: 简单查看答案及解析
-
下图是同学们经常使用的某品牌修正液包装标签。小明仔细阅读后,结合自己的生活经验和所学知识得出了修正液的某些性质,小明的推测中不合理的是

A.其成分对纸张不具腐蚀性 B.是一种胶体,均一、稳定
C.修正液含有有毒的化学物质 D.修正液的溶剂易挥发、易燃
难度: 简单查看答案及解析
-
分类是学习和研究化学的一种常用的科学方法。下列有关分类合理的有
①根据酸分子所含的氢原子数目的多少能将酸分为一元酸、二元酸等
②根据反应中电子的转移数目的多少可将化学反应分为氧化还原反应和非氧化还原反应
③根据元素原子最外层电子数的多少将元素分为金属和非金属
④根据反应中是否有离子参加分为离子反应和非离子反应
A.有1项 B.有2项 C.有3项 D.有4项
难度: 简单查看答案及解析
-
从平时学生实验中我们发现,同学们在进行实验时,出现许多不正确的操作方式,希望同学们在今后的实验中,应该克服不规范的操作。请找出下列图示中正确的实验操作
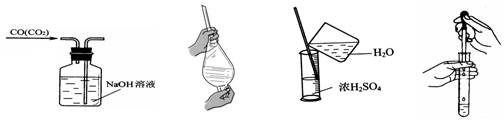
A.除去CO的CO2 B.萃取时振荡混合液
C.稀释浓硫酸 D.向试管中滴加液体
难度: 简单查看答案及解析
-
研究表明:多种海产品如虾、蟹、牡蛎等,体内含有+5价砷(As)元素,但它对人体是无毒的,砒霜的成分是As2O3,属剧毒物质,专家忠告:吃饭时不要同时大量食用海鲜和青菜,否则容易中毒,并给出了一个公式:大量海鲜+大量维生素C = 砒霜。下面有关解释不正确的是
A.维生素C能将+5价砷氧化成As2O3 B.维生素C具有还原性
C.致人中毒过程中+5价砷发生还原反应 D.青菜中含有维生素C
难度: 简单查看答案及解析
-
某溶液中可能存在Al3+、Fe2+、Fe3+,加入NaOH溶液,开始时有白色絮状沉淀,后迅速变为灰绿色,最后变为红褐色。下列结论正确的是
A.一定有Fe2+,一定没有Fe3+、Al3+
B.一定有Fe3+,一定没有Fe2+ 、Al3+
C.一定有Fe3+,可能有Fe2+,一定没有Al3+
D.一定有Fe2+,可能有Al3+,一定没有Fe3+
难度: 简单查看答案及解析
-
下列关于某溶液所含离子的检验方法和结论正确的是
A往溶液中加入BaCl2溶液和稀HNO3, 有白色沉淀生成,说明一定有SO42-.
B.加入盐酸产生能使澄清石灰水变浑浊的气体,则原溶液中一定有CO32-或SO32--
C.通入少量Cl2后,溶液变为黄色,再加入淀粉溶液后,溶液变蓝,说明有I-
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,说明有Ca2+
难度: 简单查看答案及解析
-
某无色溶液能与铝片作用生成氢气,则溶液中可能大量共存的离子组是
A.Na+ 、Mg 2+、Cu2+、Cl- B.Na+、Ca 2+、Cl-、CH3COO-
C.SO42-、HCO3-、Cl-、K + D.Cl-、Ba2+、NO3-、OH-
难度: 简单查看答案及解析
-
如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让潮湿的氯气经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色。甲瓶中所盛的试剂不可能是
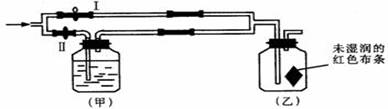
A.浓H2SO4 B.NaOH溶液 C.NaCl溶液 D. Ca(OH)2溶液
难度: 简单查看答案及解析
-
在MgCl2、KCl、K2SO4三种盐的混合溶液中,若K+、Cl-各为1.5mol,Mg2+为0.5mol,则SO42-的物质的量为
A.0.1mol B.0.5mol C.0.15mol D.0.25mol
难度: 简单查看答案及解析
-
由H2SO4、Al2O3、NaOH、Mg、Cl2两两之间进行反应,可制得的正盐有( )
A.5种 B.6种 C.7种 D.8种
难度: 简单查看答案及解析
-
等体积、等物质的量浓度的盐酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积之比为5:6,则甲、乙两烧杯中的反应情况可能分别是
A.甲、乙中都是铝过量 B.甲中酸过量、乙中铝过量
C.甲中铝过量、乙中碱过量 D.甲中酸过量、乙中碱过量
难度: 简单查看答案及解析
-
设NA代表阿伏加德罗常数,下列说法正确的是
A.Fe与0.1molCl2反应时失去的电子数为0.3NA.
B.常温常压下,1mol氦气的质量为4g
C.常温常压下, 1.12 LO2所含氧原子数为NA
D.标准状况下,2.24 L HCl气体溶于1 L水配成溶液, 可得浓度为0.1 mol/L盐酸
难度: 简单查看答案及解析
-
将50mL某未知浓度的AlCl3溶液分别加到60mL1mol/LNaOH溶液或是60mL3mol/LNaOH溶液中,均能得到1.56gAl(OH)3沉淀,则AlCl3溶液的浓度可能是
A.0.4mol/L B. 0.5mol/L C.0.6mol/L D.1mol/L
难度: 简单查看答案及解析
-
向X的溶液中,加入Y试剂,产生的沉淀或气体如图所示与所述情形相符的是( )
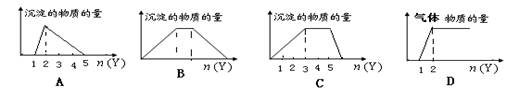
A. 向HCl和AlCl3的混合液中滴加NaOH
B.向NaOH和Ca(OH)2的混合液中通入CO2
C.向NH4Al(SO4)2溶液中滴加NaOH
D.向NaOH和Na2CO3的混合液中滴加稀HCl
难度: 简单查看答案及解析
-
将3.48gFe3O4完全溶解于100mL0.5mol/L硫酸中,然后加入K2Cr2O7溶液25mL ,恰好使溶液中Fe2+全部转化为Fe3+,Cr2O72-全部还原为Cr3+,则K2Cr2O7溶液的物质的量浓度为
A. 0.05mol/L B. 0.1mol/L C.0.2mol/L D.0.3mol/L
难度: 简单查看答案及解析
-
下表中对离子方程式的评价不合理的是
选项
化学反应及其离子方程式
评价
A.
向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全2Al3++3SO42- +3Ba2++6OH-=3BaSO4↓+2 Al(OH)3↓
不正确
B.
向碳酸氢钠溶液中滴入过量石灰水:2HCO3-+Ca2++2OH-= CaCO3↓+2H2O+ CO32-
正确
C.
铁粉与稀硫酸反应:
2Fe+ 6H+ == 2Fe3+ + 3H2↑
不正确, H+的氧化性较弱,只能将铁单质氧化为Fe2+
D.
向硫酸铵溶液中加入氢氧化钡溶液:
Ba2+ + SO42- == BaSO4↓
不正确
难度: 简单查看答案及解析
-
将含O2和CH4的混合气体充入装有23.4gNa2O2的密闭容器中点燃,反应结束后,容器温度为150℃,压强为0pa,将残留物溶于水无气体逸出。下列叙述正确的是
A.原混合气体中O2和CH4的体积比为1:2
B.原混合气体中O2和CH4的体积比为2:1
C. 残留固体中只有Na2CO3
D.残留固体中有NaHCO3和NaOH
难度: 简单查看答案及解析
-
离子方程式BaCO3+2H+=CO2↑+H2O+ Ba2+中的H+不能代表的物质是
①HCl ②H2SO4 ③HNO3 ④NaHSO4 ⑤CH3COOH
A.③ B.②⑤ C.②④⑤ D.⑤
难度: 简单查看答案及解析
-
用高铁酸钠(Na2FeO4)对河水和湖水消毒是城市饮用水处理的新技术。已知反应:Fe2O3+3Na2O2=2Na2FeO4+Na2O。下列说法正确的是( )
A.Na2FeO4既是氧化产物又是还原产物
B.Na2O2既是氧化剂又是还原剂
C. 3mol Na2O2发生反应,有12 mol电子转移
D.在Na2FeO4中Fe为+4价,具有强氧化性
难度: 简单查看答案及解析