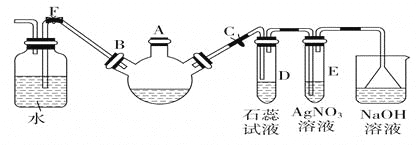
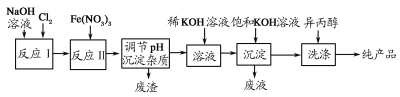
-
分子式为C5H10O2并能与饱和NaHCO3溶液反应放出气体的有机物有(不含立体异构)
A.3种 B.4种 C.5种 D.6种
难度: 中等查看答案及解析
-
下列化学用语表达正确的是( )
A.羟基电子式:
B.丙烷分子的比例模型:
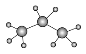
C.乙醛的结构简式:CH3COH D.丙烯的实验式:CH3CH=CH2
难度: 简单查看答案及解析
-
下列叙述中正确的是
A.相对分子质量相同、结构不同的化合物一定是互为同分异构体关系
B.结构对称的烷烃,其一氯取代产物必定只有一种结构
C.互为同分异构体的化合物不可能具有相同的结构简式
D.含不同碳原子数的烷烃不一定是互为同系物的关系
难度: 简单查看答案及解析
-
甲、乙两种有机物的某些性质如下表所示:
熔点/℃
沸点/℃
密度
溶解性
甲
26
161
0.9618 g·cm-3
微溶于水,可溶于乙
乙
-117.3
78.5
0.789 g·cm-3
与水以任意比互溶
要除去混入甲中少量的乙,应采用的方法是( )
A.重结晶法 B.分液法 C.蒸馏法 D.过滤法
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A.通过质谱法只能确认有机化合物的相对分子质量,一般无法确定其结构
B.甲苯分子中的核磁共振氢谱中有4个不同的吸收峰
C.红外光谱可以帮助确定许多有机物的结构
D.某有机物完全燃烧只生成CO2和H2O,两者物质的量之比为1∶2,则该有机物为甲烷
难度: 简单查看答案及解析
-
向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是
操作
现象
结论
A
滴加BaCl2溶液
生成白色沉淀
原溶液中有
B
滴加氯水和CCl4,振荡,静置
下层溶液显紫色
原溶液中有I-
C
用洁净铂丝蘸取溶液进行焰色反应
火焰呈黄色
原溶液中有Na+、无K+
D
滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口
试管不变蓝
原溶液中无
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列各组有机物中,无论以何种比例混合,只要二者的物质的量之和不变,完全燃烧时消耗的氧气及生成的水的物质的量也不变的是
A.C2H2和C6H6
B.C2H6和C2H5OH
C.C2H4和C2H6O
D.C6H6和C7H6O2
难度: 中等查看答案及解析
-
科罗拉多大学的克利斯托(S.Cristol)等人合成了一种有机分子,这种分子让他想起罗马的两面神Janus—罗马的守门神,克利斯托的同事迈金泰(Macintyre)就建议将该分子叫做Janusene。该有机物的结构简式如图所示:
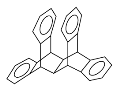
下列说法正确的是( )
A.该有机物属于苯的同系物
B.该有机物完全燃烧生成CO2和H2O的物质的量之比为15∶11
C.该有机物的一氯代物只有4种
D.该有机物只能发生取代反应而不能发生加成反应
难度: 中等查看答案及解析
-
下面各项对有机物的分类方法错误的是( )
A.
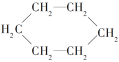 属于环状化合物
属于环状化合物B.
属于卤代烃
C.
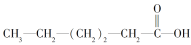 属于链状化合物
属于链状化合物D.
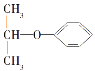 属于酮
属于酮难度: 简单查看答案及解析
-
设阿伏加德罗常数的数值为NA,下列说法中正确的是( )
A.1 mol苯乙烯中含有的C=C键数为4NA
B.2.8 g由乙烯和丙烯组成的混合气体中含有的碳原子数为0.2NA
C.0.1 mol CnH2n+2中含有的C—C键数为0.1nNA
D.标准状况下,2.24 L C2H5OH中含有的氧原子数为0.1NA
难度: 中等查看答案及解析
-
下列说法不正确的是
①CH3—CH=CH2和CH2=CH2的最简式相同
②CH≡CH和C6H6含碳量相同
③丁二烯和丁烯为同系物
④正戊烷、异戊烷、新戊烷的沸点逐渐变低
⑤标准状况下,11.2 L的庚烷所含的分子数为0.5NA(NA为阿伏加德罗常数)
⑥能够快速、微量、精确地测定相对分子质量的物理方法是核磁共振谱法
A.①⑤⑥ B.②③④ C.③⑤⑥ D.④⑤⑥
难度: 简单查看答案及解析
-
下列分离方法不合理的是( )
A.用分馏的方法,可从石油中得到汽油
B.提取溴水中的溴,可用加入乙醇萃取的方法
C.只含有泥沙的粗盐,可通过溶解、过滤、结晶的方法提纯
D.除FeCl2溶液中的少量FeCl3,可用加入足量铁屑过滤的方法
难度: 中等查看答案及解析
-
某有机物的结构简式如图所示,有关说法正确的是( )
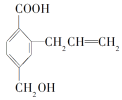
A.分子式为C11H11O3
B.能发生取代、加成、酯化等反应
C.既不能使酸性高锰酸钾溶液褪色,也不能使溴水褪色
D.1 mol该有机物能与1 mol Na反应
难度: 中等查看答案及解析
-
最简式相同,但既不是同系物,又不是同分异构体的是( )
①辛烯和3甲基1丁烯 ②苯和乙炔 ③1氯丙烷和2氯丙烷 ④甲基环己烷和乙烯
A.①② B.②③ C.③④ D.②④
难度: 中等查看答案及解析
-
下列有关反应限度的叙述正确的是
A.大多数化学反应在一定条件下都有一定的限度
B.依据焓判据:NH4HCO3受热分解可自发进行
C.使用催化剂,可降低反应的活化能,加快反应速率,改变反应限度
D.FeCl3与KSCN反应达到平衡时,向其中滴加KCl溶液,则溶液颜色变深
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中:Ba2+、H+、MnO4-、Br-
B.加入铝粉产生H2的溶液中:Cu2+、Na+、SO42-、ClO-
C.滴入KSCN溶液显红色的溶液中:K+、Mg2+、SO42-、Cl-
D.滴加甲基橙试剂显红色的溶液中:Na+、Fe2+、Cl-、NO3-
难度: 中等查看答案及解析
-
如图所示,电解一段时间后,银阴极的质量增加了0.648 g,金属X阴极的质量增加了0.195g,则X的摩尔质量为( )
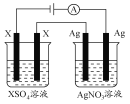
A.65g/mol B.32.5g/mol C.28g/mol D.56g/mol
难度: 中等查看答案及解析
-
关于有机物
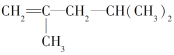 的下列叙述中,正确的是( )
的下列叙述中,正确的是( )A.它的系统名称是2,4-二甲基-4-戊烯 B.它不能使酸性高锰酸钾溶液褪色
C.它与甲基环己烷互为同分异构体 D.该有机物的一氯取代产物共有4种
难度: 简单查看答案及解析
-
下列说法中不正确的是( )
A.红外光谱仪、核磁共振仪、质谱仪都可用于有机物的结构分析
B.HCHO中含有的官能团是羟基
C.聚乙烯与乙烯不是同系物
D.2,5-二甲基己烷的核磁共振氢谱中出现了三个峰
难度: 中等查看答案及解析
-
某有机物结构简式为
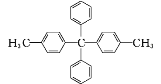 ,对该有机物分子的描述正确的是
,对该有机物分子的描述正确的是A. 最多有7个碳原子共线 B. 所有碳原子都在同一平面上
C. 其一氯代物最多有5种 D. 最多有25个原子共面
难度: 困难查看答案及解析
-
下列关于水的说法正确的是( )
A.常温下正常雨水的pH为7.0,酸雨的pH小于7.0
B.将25℃纯水加热至95℃时,
增大
C.将纯水加热到95℃时,水的离子积变大,pH不变,水仍呈中性
D.向水中加入醋酸或醋酸钠,均可促进水的电离
难度: 中等查看答案及解析
-
下列化学方程式书写错误的是( )
A.乙醇催化氧化制取乙醛:2CH3CH2OH+O2
2CH3CHO+2H2O
B.苯与浓硫酸、浓硝酸的混合液共热制硝基苯:
+HNO3
C.乙酸和乙醇发生反应生成乙酸乙酯:CH3CH2OH+CH3COOH
CH3COOC2H5+H2O
D.乙烯使溴的四氯化碳溶液褪色:CH2=CH2+Br2→CH2Br—CH2Br
难度: 简单查看答案及解析
-
维生素A对人的视力有非常重要的作用,其结构简式如下图:
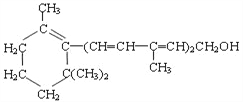
①维生素A是一种不饱和一元醇;②维生素A含有苯环结构;③维生素A含有两种官能团;④维生素A的一个分子中含有3个双键。以上关于该化合物的说法正确的是
A.②④ B.①③ C.③④ D.全部正确
难度: 中等查看答案及解析
-
在容积不变的密闭容器中,一定条件下发生反应:2A
B(g)+2C(g),且达到平衡。当升高温度时气体的密度增大,则下列叙述中正确的是
A.升高温度,正反应速率增大,逆反应速率减小
B.若正反应是放热反应,则A为气态
C.物质A一定为非气态,且正反应是吸热反应
D.若向容器中充入惰性气体,则平衡向右移动
难度: 简单查看答案及解析
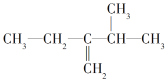 ________。
________。