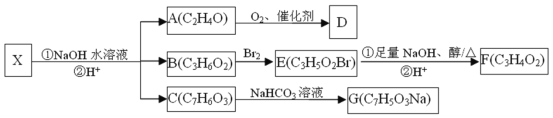
-
分子式为C7H8的某有机物,它能使酸性高锰酸钾溶液褪色,但不能使溴水因化学反应而褪色,在一定条件下与H2完全加成产物的一氯代物的同分异构体有( )
A.3种 B.4种 C.5种 D.6种
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A.Na2O2能与CO2反应,可用作呼吸面具的供氧剂
B.SiO2有导电性,可用于制备光导纤维
C.明矾能水解生成Al(OH)3胶体,可用作净水剂
D.Al2O3熔点高,可用于制作耐高温仪器
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.能使酚酞变红的溶液:Na+、Ba2+、NO3-、Cl-
B.含有0.1 mol·L-1 Fe3+的溶液中:K+、Mg2+、I-、SO42-
C.能溶解Al(OH)3的溶液:NH4+、K+、SO42-、HCO3-
D.c(Al3+)=0.5 mol·L-1的溶液中:Na+、K+、[Al(OH)4]-、SO42-
难度: 中等查看答案及解析
-
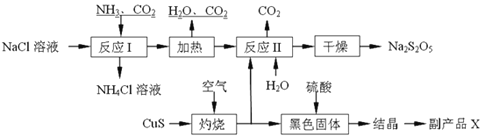
新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化。常温下,MFe2Ox能使工业废气中的SO2转化为S,流程如下:
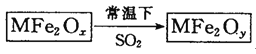
则下列判断正确的是( )
A.x>y B.MFe2Ox是还原剂 C.SO2是该反应的催化剂 D.SO2发生了置换反应
难度: 中等查看答案及解析
-
W、X、Y、Z是原子序数依次增大的四种短周期元素,化合物WX能抑制水的电离。化合物Y2Z能促进水的电离,则Y元素是( )
A.F B.Cl C.Li D.Na
难度: 中等查看答案及解析
-
物质的量浓度相等的三种溶液:①H2CO3 ②NaOH ③Na2CO3溶液,下列说法不正确的是( )
A.水电离出的c(H+):③>①>②
B.溶液的pH:②>③>①
C.①和②等体积混合后的溶液:
D.①和③等体积混合后的溶液:
难度: 中等查看答案及解析
-
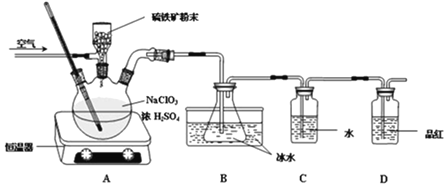
下列图示实验合理的是
A.
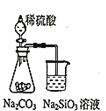 为证明非金属性强弱:Si<C<S
为证明非金属性强弱:Si<C<SB.
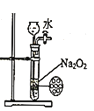 为制备少量氧气
为制备少量氧气C.
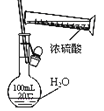 为配制一定浓度硫酸溶液
为配制一定浓度硫酸溶液D.
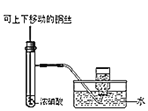 制备并收集少量NO2气体
制备并收集少量NO2气体难度: 简单查看答案及解析