-
下列各组物质之间的转化不是全部通过一步反应完成的是( )
A.Na→NaOH→Na2CO3→NaCl B.Al→Al2O3→Al(OH)3→AlCl3
C.Mg→MgCl2→Mg(OH)2→MgSO4 D.Fe→FeCl2→Fe(OH)2→Fe(OH)3
难度: 中等查看答案及解析
-
主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。W、X、Z最外层电子数之和为10;W与Y同族;W与Z形成的化合物可与浓硫酸反应,其生成物可腐蚀玻璃。下列说法正确的是
A.常温常压下X的单质为气态
B.Z的氢化物为离子化合物
C.Y和Z形成的化合物的水溶液呈碱性
D.W与Y具有相同的最高化合价
难度: 中等查看答案及解析
-
下列叙述正确的是
A.两种微粒,若核外电子排布完全相同,则其化学性质一定相同
B.凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布
C.两原子如果核外电子排布相同,则一定属于同种元素
D.阴离子的核外电子排布一定与上一周期稀有气体原子的核外电子排布相同
难度: 中等查看答案及解析
-
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,且四种元素的原子最外层电子数之和为24。下列叙述不正确的是
W
X
Y
Z
A.简单阴离子的还原性Y强于X
B.W的气态氢化物与其最高价含氧酸反应生成离子化合物
C.X、Y、Z最简单氢化物中稳定性最弱的是Y
D.在元素周期表中118号元素与Z位于同一主族
难度: 中等查看答案及解析
-
最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
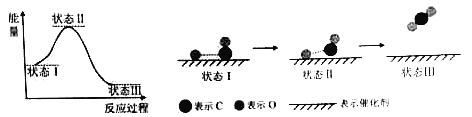
下列说法中正确的是
A.CO和O生成CO2是吸热反应
B.在该过程中,CO断键形成C和O
C.CO和O生成了具有极性共价键的CO2
D.状态Ⅰ →状态Ⅲ表示CO与O2反应的过程
难度: 中等查看答案及解析
-
下列说法正确的是
A.HCl的电子式为H:Cl
B.Na2O2只含有离子键
C.质量数为12的C原子符号为12C
D.用电子式表示KBr的形成过程:
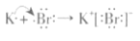
难度: 简单查看答案及解析
-
下列说法正确的是
A.化学反应中的能量变化都表现为热量的变化
B.吸热反应在不加热的条件一定不能发生
C.需要加热才能发生的反应一定是吸热反应,放热反应在常温下一定很容易发生
D.反应是吸热还是放热必须看旧键断裂时吸收的能量和新键生成时释放的能量的大小
难度: 中等查看答案及解析
-
用3g块状大理石与30mL3mol·L-1盐酸反应制取CO2气体,若要增大反应速率,可采取的措施是( )
①再加入30mL3mol·L-1盐酸
②改用30mL6mol·L-1盐酸
③改用3g粉末状大理石
④适当升高温度
A.①②④ B.②③④ C.①③④ D.①②③
难度: 简单查看答案及解析
-
Mg-AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为2AgCl+Mg=Mg2++2Ag+2Cl-。有关该电池的说法正确的是
A.Mg为电池的正极
B.负极反应式为AgCl+e-=Ag+Cl-
C.可用于海上应急照明供电
D.电池工作时,电解质溶液质量不断减轻
难度: 中等查看答案及解析
-
W、X、Y、Z属于短周期元素,其性质或原子结构特点如下表,下列说法不正确的是
W
能形成两种常见的氧化物,其中一种可作为呼吸面具中的供氧剂
X
其单质为双原子分子,且呈黄绿色
Y
与X同周期,且离子半径为本周期最小
Z
Z的一种核素在考古时常用来鉴定一些文物的年代
A.X分别与W和Y形成的化合物中含有相同的化学键
B.W、X、Y的最高价氧化物的水化物之间可以两两反应
C.X与Z形成的最简单的化合物中X、Z均满足8电子稳定结构
D.1 mol W与氧气完全反应转移的电子数为NA
难度: 中等查看答案及解析
-
下列物质反应后一定有+3价铁生成的是( )
①Fe与过量的S反应
②Fe与过量稀硫酸反应后,再向其中加KNO3
③Fe(NO3)2溶液中加少量盐酸
④Fe和Fe2O3的混合物溶于盐酸中
A.①② B.②③ C.①②③ D.①②③④
难度: 简单查看答案及解析
-
下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )

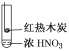
①
②
③
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
难度: 困难查看答案及解析
-
下列说法中正确的是
①离子化合物中一定有离子键,可能有共价键
②离子化合物都属于强电解质
③非金属单质中不含离子键,一定只含有共价键
④稳定性:H2O>H2S,沸点:H2O<H2S
⑤NaCl 和 HCl 溶于水破坏相同的作用力
⑥非极性键可能存在于非金属单质中,也可能存在于离子化合物或共价化合物中
A.①②⑥ B.①③④⑥ C.③④⑤⑥ D.①④⑤
难度: 困难查看答案及解析
-
在一绝热(不与外界发生热交换)的恒容容器中,发生反应:2A(g)+B(s)
C(g)+D(g),下列描述中能表明反应已达到平衡状态的有( )个
①容器内温度不变 ②混合气体的密度不变 ③混合气体的压强不变
④混合气体的平均相对分子质量不变 ⑤C(g)的物质的量浓度不变
⑥容器内A、C、D三种气体的浓度之比为2:1:1 ⑦某时刻v(A)=2v(C)且不等于零
⑧单位时间内生成n mol D,同时生成2n mol A
A.4 B.5 C.6 D.7
难度: 困难查看答案及解析
-
科学家宣布发现了铝的“超级原子”结构———Al13和Al14。 已知这类“超级原子”最外层电子数之和为40个时处于相对稳定状态。下列说法中,正确的是
A.Al13、Al14互为同位素
B.Al13超原子中Al原子间通过离子键结合
C.Al13和Al14都具有较强的还原性,容易失去电子生成阳离子
D.Al14最外层电子数之和为42,与第ⅡA族元素原子的性质相似
难度: 中等查看答案及解析
-
我国首艘使用了钛合金材料的国产航母已成功下水,钛(Ti)常温下与酸、碱均不反应,但高温下能被空气氧化,由钛铁矿(主要成分是FeO和TiO2)提取金属钛的主要工艺流程如图。下列说法错误的是( )
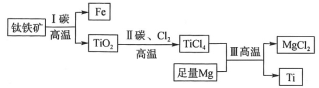
A.步骤Ⅰ中碳作还原剂
B.步骤Ⅱ中未发生氧化还原反应
C.步骤Ⅲ中需在氩气环境中进行,防止金属被空气氧化
D.可用稀硫酸除去金属钛中的少量镁
难度: 中等查看答案及解析
-
世界某著名学术刊物介绍了一种新型中温全瓷铁空气电池,其结构如图所示。
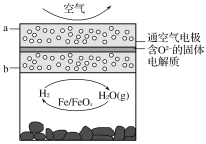
下列有关该电池放电时的说法正确的是( )
A.a极发生氧化反应
B.正极的电极反应式为FeOx+2xe-=Fe+xO2-
C.若有22.4 L(标准状况)空气参与反应,则电路中有4 mol电子转移
D.铁表面发生的反应为xH2O(g)+Fe=FeOx+xH2
难度: 困难查看答案及解析
-
下列叙述正确的是
A.SiO2既能和NaOH溶液反应,又能和HF反应,所以SiO2属于两性氧化物
B.因为Na2CO3+SiO2
Na2SiO3+CO2↑,所以H2SiO3的酸性比H2CO3强
C.CO2和SiO2都能与C反应
D.CO2和SiO2都是酸性氧化物,所以两者物理性质相似
难度: 中等查看答案及解析