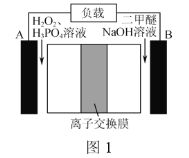
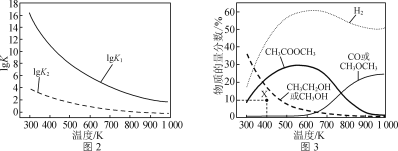
-
“84消毒液”可消杀新冠病毒,可用Cl2与NaOH溶液反应制备。下列关于“84消毒液”的说法不正确的是( )
A.属于胶体 B.有效成分为NaClO
C.室温下溶液pH大于7 D.有强氧化性
难度: 简单查看答案及解析
-
用化学用语表示2Na2O2+2H2O=4NaOH+O2↑中相关微粒,其中正确的是( )
A.中子数为0的氢原子:
H B.Na+的结构示意图:
C.H2O的结构式:
D.O22-的电子式:
难度: 简单查看答案及解析
-
下列有关物质性质与用途具有对应关系的是( )
A.硅酸钠溶液呈碱性,可用作木材防火剂
B.硫酸铜溶液呈蓝色,可用作游泳池中水的消毒剂
C.浓硫酸具有强氧化性,可用作酯化反应的催化剂
D.铅具有还原性和导电性,可用作铅蓄电池的负极材料
难度: 简单查看答案及解析
-
室温下,下列各组离子在指定溶液中能大量共存的是( )
A.pH=2的溶液:Na+、Fe2+、I-、NO3-
B.c(AlO2-)=0.1 mol·L-1的溶液:K+、Na+、OH-、SO42-
C.
=0.1 mol·L-1的溶液:Na+、NH4+、SiO32-、ClO-
D.c(Fe3+)=0.1 mol·L-1的溶液:Mg2+、NH4+、Cl-、SCN-
难度: 简单查看答案及解析
-
实验室可用反应2CuSO4+2KI+SO2+2H2O=2CuI↓+2H2SO4+K2SO4来制备CuI(CuI受热易被氧化)。下列实验装置和操作不能达到实验目的的是 ( )
A.
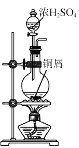 用装置制备SO2
用装置制备SO2B.
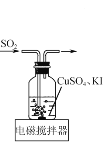 用装置制备CuI
用装置制备CuIC.
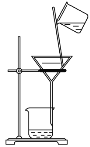 用装置分离出CuI
用装置分离出CuID.
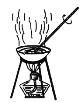 用装置干燥CuI固体
用装置干燥CuI固体难度: 简单查看答案及解析
-
下列关于物质性质的叙述正确的是( )
A.SiO2与浓盐酸在高温下能反应生成SiCl4
B.木炭与浓硫酸共热可生成CO2
C.明矾溶液中加入过量NaOH溶液可制备Al(OH)3胶体
D.向饱和食盐水中通入足量CO2可制得NaHCO3
难度: 简单查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A.Fe与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
B.向K2CO3溶液中通入过量SO2:CO
+2SO2+H2O=CO2+2HSO
C.在强碱溶液中NaClO与FeCl3反应生成Na2FeO4:3ClO-+2Fe3++5H2O=2 FeO
+3Cl-+10H+
D.用新制的Cu(OH)2检验乙醛中的醛基:CH3CHO+Cu(OH)2+OH-
CH3COO-+Cu+2H2O
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,其中Y是金属元素。X原子的最外层电子数是其电子层数的2倍,Z原子的最外层有6个电子,X、Y、W原子最外层电子数之和等于12。下列叙述正确的是( )
A.Z分别与X、Y形成的化合物中化学键类型相同
B.原子半径:r(Y)<r(Z)<r(W)
C.工业上常用电解的方法制备元素Y的单质
D.元素X的最高价氧化物对应水化物的酸性比W的强
难度: 简单查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.MgCl2(aq)
Mg(OH)2(s)
MgO(s)
B.H2SO4(浓)
SO2(g)
BaSO3(s)
C.Fe2O3(s)
FeCl3(aq)
Fe(s)
D.SiO2(s)
H2SiO3(胶体)
Na2SiO3(aq)
难度: 中等查看答案及解析
-
一种熔盐捕获CO2的装置如图所示。该装置工作时,下列说法正确的是( )
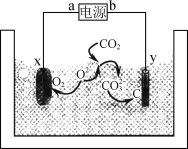
A.a为电源的负极
B.x极使用石墨不会损耗
C.y极电极反应式为CO32-+4e-=C+3O2-
D.电路中转移1 mol e-,理论上可捕获5.6 L CO2
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,所得溶液pH>7
B.室温下,Na2CO3溶液中加入少量Ca(OH)2固体,溶液中
的值增大
C.在外加电流的阴极保护法中,须将被保护的钢铁设备与直流电源的负极相连
D.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下能自发进行,该反应的ΔH>0
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得到的结论正确的是( )
选项
实验操作和现象
结论
A
向苯酚浊液中加入Na2CO3溶液,溶液变澄清
电离出H+的能力:苯酚>HCO3-
B
将亚硫酸钠样品溶于水,加入盐酸酸化后再滴加Ba(NO3)2溶液,有白色沉淀产生
样品已变质
C
将乙醇与浓硫酸混合加热,产生的气体通入酸性KMnO4溶液,溶液紫红色褪去
产生的气体中一定含有乙烯
D
在2 mL 0.01 mol·L-1Na2S溶液中先滴入几滴0.01 mol·L-1CuSO4溶液有黑色沉淀生成,再滴入0.01 mol·L-1ZnSO4溶液,又有白色沉淀生成
Ksp(ZnS)<Ksp(CuS)
A.A B.B C.C D.D
难度: 中等查看答案及解析
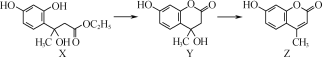
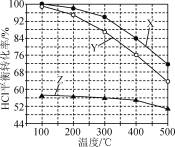
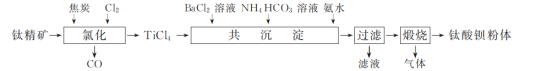
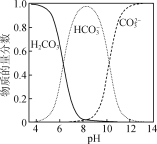
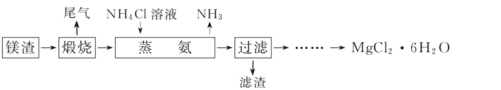
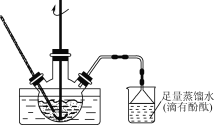
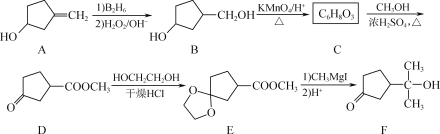
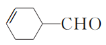 、CH3OH和CH3CH2MgI为主要原料制备
、CH3OH和CH3CH2MgI为主要原料制备