-
[2017江苏]某科研小组采用如下方案回收一种光盘金属层中的少量Ag(金属层中其他金属含量过低,对实验的影响可忽略)。

已知:①NaClO溶液在受热或酸性条件下易分解,如:3NaClO
2NaCl+NaClO3
②AgCl可溶于氨水:AgCl+2NH3·H2O
Ag(NH3) 2++ Cl− +2H2O
③常温时N2H4·H2O(水合肼)在碱性条件下能还原Ag(NH3)2+:
4Ag(NH3) 2++N2H4·H2O
4Ag↓+N2↑+4
+4NH3↑+H2O
(1)“氧化”阶段需在80℃条件下进行,适宜的加热方式为__________________。
(2)NaClO溶液与Ag反应的产物为AgCl、NaOH和O2,该反应的化学方程式为________________。 HNO3也能氧化Ag,从反应产物的角度分析,以HNO3代替NaClO的缺点是__________________________________________。
(3)为提高Ag的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,并_______________________。
(4)若省略“过滤Ⅰ”,直接向冷却后的反应容器中滴加10%氨水,则需要增加氨水的用量,除因过量NaClO与NH3·H2O反应外(该条件下NaClO3与NH3·H2O不反应),还因为__________________。
(5)请设计从“过滤Ⅱ”后的滤液中获取单质Ag的实验方案:________________________(实验中须使用的试剂有:2 mol·L−1水合肼溶液,1 mol·L−1H2SO4)。
难度: 中等查看答案及解析
-
[2017北京]SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。
(1)SCR(选择性催化还原)工作原理:

① 尿素[CO(NH2)2]水溶液热分解为NH3和CO2,该反应的化学方程式:____________。
② 反应器中NH3还原NO2的化学方程式:____________。
③ 当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4,使催化剂中毒。用化学方程式表示(NH4)2SO4的形成:________。
④ 尿素溶液浓度影响NO2的转化,测定溶液中尿素(M=60 g·mol −1)含量的方法如下:取a g尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的v1 mL c1 mol·L−1 H2SO4溶液吸收完全,剩余H2SO4用v2 mL c2 mol·L−1 NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是________。
(2)NSR(NOx储存还原)工作原理:
NOx的储存和还原在不同时段交替进行,如图a所示。

① 通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原。储存NOx的物质是_________。
② 用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。第一步反应消耗的H2与Ba(NO3)2的物质的量之比是__________。
③ 还原过程中,有时会产生笑气(N2O)。用同位素示踪法研究发现笑气的产生与NO有关。在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。将该反应的化学方程式补充完整:_______
□15NNO+□H2O
难度: 中等查看答案及解析
-
[2016新课标Ⅰ]NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
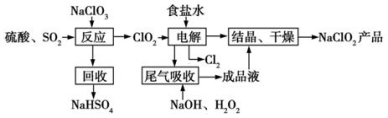
回答下列问题:
(1)NaClO2中Cl的化合价为_______。
(2)写出“反应”步骤中生成ClO2的化学方程式_______。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为________、________。“电解”中阴极反应的主要产物是____________。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应中,氧化剂与还原剂的物质的量之比为___________,该反应中氧化产物是____________。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为__________。(计算结果保留两位小数)
难度: 中等查看答案及解析
-
[2016上海]NaCN超标的电镀废水可用两段氧化法处理:
(1)NaCN与NaClO反应,生成NaOCN和NaCl
(2)NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2
已知HCN(Ki=6.3×10−10)有剧毒;HCN、HOCN中N元素的化合价相同。
完成下列填空:
(1)第一次氧化时,溶液的pH应调节为____________________(选填“酸性”、“碱性”或“中性”);原因是______________________________。
(2)写出第二次氧化时发生反应的离子方程式:_______________________________________
(3)处理100 m3含NaCN 10.3 mg/L的废水,实际至少需NaClO___________g(实际用量应为理论值的4倍,才能使NaCN含量低于0.5 mg/L,达到排放标准)。
(4)(CN)2与Cl2的化学性质相似。(CN)2与NaOH溶液反应生成_________、__________和H2O。
(5)上述反应涉及到的元素中,氯原子核外电子能量最高的电子亚层是___________;H、C、N、O、Na的原子半径从小到大的顺序为_______。
(6)HCN是直线型分子,HCN是___________分子(选填“极性”、“非极性”)。HClO的电子式为___________。
难度: 中等查看答案及解析