-
下列有关环境保护与绿色化学的叙述不正确的是( )
A. 形成酸雨的主要物质是硫的氧化物和氮的氧化物
B. 大气污染物主要来自化石燃料燃烧和工业生产过程产生的废气
C. 绿色化学的核心就是如何对被污染的环境进行无毒无害的治理
D. 水华、赤潮等水体污染主要是由含氮、磷的生活污水任意排放造成的
难度: 简单查看答案及解析
-
下列关于电池的叙述不正确的是
A. 电他充电是使放电时的氧化还原反应的逆向进行
B. 较长时间不使用电器时,最好从电器中取出电池,并妥善存放
C. 氢氧燃料电池产物为无污染的水,属于环境友好电池
D. 燃料电池的能量转化率可达100%
难度: 简单查看答案及解析
-
下列对化学反应的认识错误的是
A. 必然引起物质状态的变化 B. 会产生新的物质
C. 会引起化学键的变化 D. 必然伴随着能量的变化
难度: 简单查看答案及解析
-
下列反应中,属于取代反应的是
A. CH2=CH2+H2O
CH3-CH2OH B.
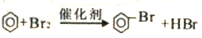
C. CH3CH2OH
CH2=CH2+H2O D. CH4
C+2H2
难度: 简单查看答案及解析
-
石油分馏塔装置示意如图。a、b、c分别为石油分馏产品。下列说法正确的是

A. 在a、b、c三种馏分中,a的熔点最高
B. 分馏产品的沸点:a>b>c>柴油>重油
C. 在a、b、c三种馏分中,c的平均相对分子质量最大
D. a、b、c、柴油、重油都是纯净物
难度: 中等查看答案及解析
-
自然界为人类提供了多种多样的营养物质,下列有关营养物质的说法正确的是
A. 麦芽糖、淀粉、纤维素都可以发生水解反应
B. 食用纤维素、蛋白质、脂肪和植物油都是高分子化合物
C. 棉花和蚕丝的主要成份都是纤维素
D. 油脂都不能使溴水褪色
难度: 简单查看答案及解析
-
已知:15P、33As位于同一主族,下列关系正确的是
A. 原子半径:As>Cl>P B. 热稳定性:HCl>PH3>AsH3
C. 非金属性:Cl>As>S D. 酸性:H3AsO4>H2SO4>H3PO4
难度: 中等查看答案及解析
-
下列关于化学反应速率的说法正确的是( )
A. 1 L 0.1 mol·L-1盐酸和1 L 0.1 mol·L-1硫酸分别与1 L 2 mol·L-1 NaOH溶液反应速率相同
B. 化学反应速率为0.8 mol·L-1·s-1,其含义是时间为1s时,某物质的浓度是0.8 mol·L-1
C. 0.1 mol·L-1盐酸和0.1 mol·L-1硝酸与相同形状和大小的大理石反应的速率相同
D. 对于任何化学反应来说,反应速率越大,反应现象就越明显
难度: 简单查看答案及解析
-
某烷烃的一种同分异构体只能生成一种一氯代物,该烃的分子式可能是
A. C3H8 B. C4H10 C. C5H12 D. C6H14
难度: 困难查看答案及解析
-
下列关于海水资源综合利用的说法中,正确的是( )
A. 海水蒸发制海盐的过程只发生化学变化
B. 只通过物理变化即可从海水中提取溴单质
C. 从海水中可以得到MgCl2,可电解MgCl2溶液制备Mg
D. 海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等
难度: 中等查看答案及解析
-
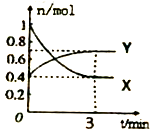
对于密闭容器中进行的可逆反应:2SO2(g)+O2(g)
2SO3(g),下列能说明该反应已经达到化学反应限度的是
A. SO2、O2、SO3的浓度相等
B. SO2、O2、SO3的浓度不再发生变化
C. SO2、O2、SO3密闭容器中共存
D. 反应停止,正、逆反应速率都等于零
难度: 简单查看答案及解析
-
在盛有稀硫酸的烧杯中,放入用导线连接的铜片和锌片,下列说法正确的是
A. 负极发生还原反应
B. 电子通过导线由铜片流向锌片
C. 正极上有氢气逸出,正极电极反应式为:2H++2e-=H2↑
D. 负极附近的SO42-离子浓度逐渐增大
难度: 中等查看答案及解析
-
加碘盐的主要成分是NaCl,还添加了适量的KIO3,下列说法中正确的是
A. KIO3和NaCl为离子化合物,均只含离子健
B. KIO3中阳离子的结构示意图为

C. KIO3只有氧化性,无还原性
D. 23Na37Cl中质子数和中子数之比是7:8
难度: 中等查看答案及解析
-
已知镓和铝在周期表中位于同一纵行,氮化镓可把手机信号扩大10倍,让电脑的速度提高l万倍。将CD缩减到l英寸。下列有关氮化镓的说法中正确的是
A. 氮化镓是由主族元素与副族元素形成的化合物
B. 镓元素比铝元素金属性强
C. 氮化镓中氮元素显+3 价
D. 氮原子最外层比镓原子最外层多3个电子
难度: 中等查看答案及解析
-
已知某化学反应A2(g)+2B2(g)=2AB2(g) (A2、B2、AB2的结构式分别为A=A、B-B、B-A-B),能量变化如图所示,下列有关叙述中正确的是
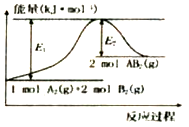
A. 该反应若生成2molAB2(g)则吸收的热量为(El-E2)kJ
B. 该反应的进行一定需要加热或点燃条件
C. 该反应断开化学键消耗的总能量小于形成化学键释放的总能量
D. 生成2molB-B键放出E2kJ能量
难度: 中等查看答案及解析
-
X、Y、Z是原子序数依次递增的短周期元素,3 种元素的原子核外电子数之和与Ca2+的核外电子数相等,X、Z分别得到一个电子后均形成稀有气体原子的稳定电子层结构。下列说法正确的是
A. 原子半径:Z>Y>X
B. Z 与 X 形成化合物的沸点高于Z 的同族元素与 X形成化合物的沸点
C. CaY2 与水发生氧化还原反应时,CaY2只作氧化剂
D. CaX2、CaY2和CaZ2 等3种化合物中,阳离子与阴离子个数比均为 1∶2
难度: 中等查看答案及解析