-
冠病毒(如图)由蛋白质和核酸组成,核酸由核苷酸组成.核苷酸的单体由五碳糖 、磷酸基和含氮碱基构成.下列说法错误的是
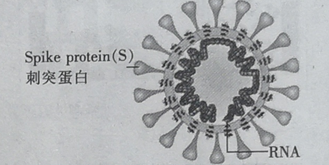
A.蛋白质和核酸均是高分子化合物
B.蛋白质中含C、H、O、N 等元素
C.五碳糖( C5H10O5)与葡萄糖互为同系物
D.NaClO溶液用作消毒剂,是因为NaClO 能使病毒蛋白变性
难度: 中等查看答案及解析
-
冠醚分子中有空穴 ,能够与金属离子形成稳定的络合物,该物质在有机工业中发挥着重要的作用。二环己烷并一18一冠一6(III )的制备原理如图,下列相关说法错误的是

A.反应是取代反应 B.能用Na鉴别I和III
C.I不能使酸性高锰酸钾溶液褪色 D.III的一溴取代物有5种
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A.11.2 LCl2通入足量的NaOH 溶液中充分反应 ,转移的电子数为 0.5NA
B.4.4 g 由 CO2 和 N2O 组成的混合气体中含有的电子总数为 2.2NA
C.常温下 ,1.0L p H= l 的 H2SO4溶液中含有H+的数目为 0.2NA
D.11.5 g乙醇分子中含有C- H键的数目为1.5NA
难度: 中等查看答案及解析
-
下列实验现象与实验操作不相匹配的是
实验操作
实验现象
A
向Fe( NO3)2 与KSCN 组成的混合溶液中滴入少量稀盐酸
溶液颜色不变
B
向稀溴水中通入足量 SO2气体
溶液的橙色逐渐褪去,最终为无色溶液
C
向新制氯水中加入少量石灰石
溶液的浅黄绿色逐渐褪去
D
将打磨光亮的铝片放置在酒精灯外焰上加热
铝片逐渐熔化但不滴落
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
短周期主族元素 W、X、Y、Z 的原子序数依次增大,W、Y 同主族,Y的次外层电子数与W的质子数相同。X的简单离子半径是 X 所处周期中最小的,Z元素是最重要的“成盐元素” 下列说法正确的是
A.原子半径由大到小的 顺序:Z> Y> X
B.Y2Z2 中含极性共价键和非极性共价链
C.Z的氧化物对应的水化物一定是强酸
D.氢化物沸点由高到低的顺序:W> Z> Y
难度: 中等查看答案及解析
-
一种钾离子电池的工作原理如图所示,下列说法正确的是
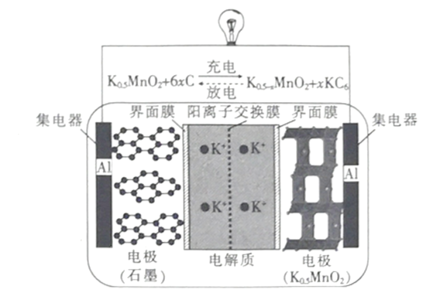
A.放电时,负极的电极反应式 :KC6 –e- =K ++6C
B.充电时,阳极的电极反应式 :K0.5-xMnO2+xK++ xe-=K0.5MnO2
C.放电时,K+ 通过阳离子交换膜向石墨电极移动
D.若仅把钾离子换成锂离子,当负极减少的质量相同时,钾离子电池转移的电子数比锂离子电池的多
难度: 困难查看答案及解析
-
室温时,H2S 的 Ka1 =1.0 ×10-7,Ka2 =1.0 ×10-15下列说法正确的是
A.0.1 mol• L-1的 NaHS溶液中:c(S2ˉ)>c(H2S)
B.反应 S2ˉ+ H2O
HSˉ+ OHˉ 的平衡常数 K=1×10-7
C.NaHS与 Na2S以任意比混合的溶液中 :c( Na+)+ c(H+)=c(HSˉ)+ c(S2ˉ)+c(OHˉ)
D.0.1 mol • L-1的Na2S 溶液中:c(OHˉ)= c(H+)+ c(HSˉ) + 2c(H2S)
难度: 中等查看答案及解析

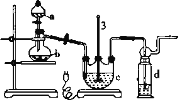
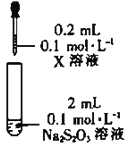
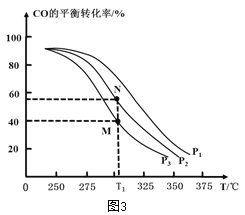
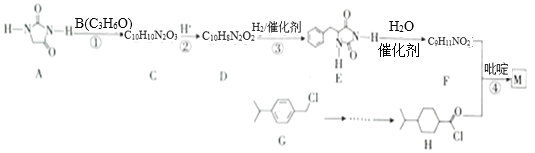
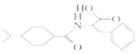 )是一种重要的降血糖药物,能有效促进胰岛素的分泌。它的一种合成方法如下
)是一种重要的降血糖药物,能有效促进胰岛素的分泌。它的一种合成方法如下