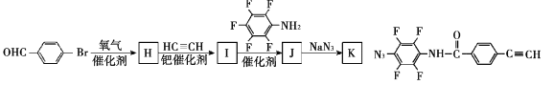
-
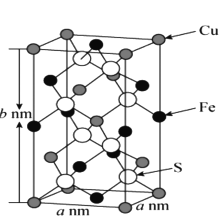
W、X、Y、Z是原子序数依次增大的前四周期元素,W、X是空气中含量最高的两种元素,Y的合金是当今世界使用量最大的合金,Z的单质常温下为液态。下列说法不正确的是
A.单质Z保存时需要加水形成液封
B.Y的金属性弱于第三周期的所有金属元素
C.W与X能形成二元化合物并非全部是酸性氧化物
D.向YZ2溶液中通人少量氯气会发生置换反应
难度: 困难查看答案及解析
-
下表中实验“操作或现象”以及“所得结论”都正确且两者具有推导关系的是
操作或现象
所得结论
A
向纯碱中滴加足量浓盐酸,将产生的气体通入苯酚钠溶液,溶液变浑浊
酸性:盐酸>碳酸>苯酚
B
取酸性KMnO4溶液少量,加入足量H2O2溶液,溶液紫红色逐渐褪去且产生大量气泡
氧化性:KMnO4>H2O2
C
用95%的酒精代替75%的酒精杀灭新型冠状病毒
高浓度酒精能让蛋白质变性更快
D
向装有适量淀粉水解液试管中加入新制的银氨溶液,然后水浴加热一段时间,试管内壁无任何现象
淀粉未水解
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
化学和生活、社会发展息息相关,从古代文物的修复到现在的人工智能,我们时时刻刻能感受到化学的魅力。下列说法不正确的是
A.
 银器发黑重新变亮涉及了化学变化
银器发黑重新变亮涉及了化学变化B.
 煤综合利用时采用了干馏和液化等化学方法
煤综合利用时采用了干馏和液化等化学方法C.
 瓷器主要成分属于硅酸盐
瓷器主要成分属于硅酸盐D.
 芯片制造中的“光刻技术”是利用光敏树脂在曝光条件下成像,该过程并不涉及化学变化
芯片制造中的“光刻技术”是利用光敏树脂在曝光条件下成像,该过程并不涉及化学变化难度: 中等查看答案及解析
-
类比推理是化学中常用的思维方法。下列推理正确的是
A.
晶体硅含
键的数目为
,则
金刚砂含
键的数目也为
B.
溶液中加入过量的
溶液,发生化学反应的方程式:
,则
溶液中加入过量的
溶液,发生化学反应的方程式:
C.标准状况下,
中所含的分子数目为
个,则
中所含的分子数目也为
个
D.
溶液中通入过量
发生了反应:
,则
溶液中通入过量
发生了:
难度: 中等查看答案及解析
-
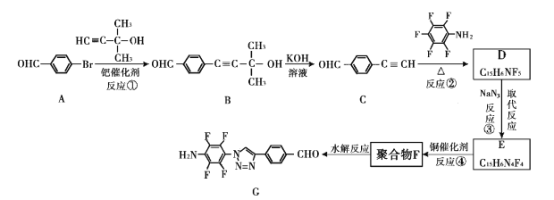
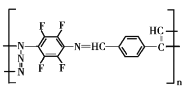
我国自主研发的对二甲苯绿色合成项目取得新进展,其合成过程如图所示。
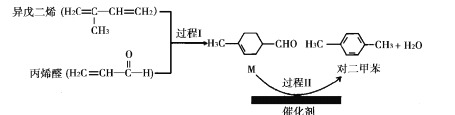
下列说法不正确的是
A.丙烯醛分子中所有原子可能共平面 B.可用溴水鉴别异戊二烯和对二甲苯
C.对二甲苯的二氯代物有6种 D.M能发生取代,加成,加聚和氧化反应
难度: 中等查看答案及解析
-
某种新型热激活电池的结构如图所示,电极a的材料是氧化石墨烯(CP)和铂纳米粒子,电极b的材料是聚苯胺(PANI),电解质溶液中含有Fe3+和Fe2+。加热使电池工作时电极b发生的反应是PANI-2e-=PANIO(氧化态聚苯胺,绝缘体)+2H+,电池冷却时Fe2+在电极b表面与PANIO反应可使电池再生。下列说法不正确的是
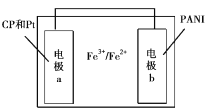
A.电池工作时电极a为正极,且发生的反应是:Fe3++e-—Fe2+
B.电池工作时,若在电极b周围滴加几滴紫色石蕊试液,电极b周围慢慢变红
C.电池冷却时,若该装置正负极间接有电流表或检流计,指针会发生偏转
D.电池冷却过程中发生的反应是:2Fe2++PANIO+2H+=2Fe3++ PANI
难度: 中等查看答案及解析
-
已知常温下HF酸性强于HCN,分别向1Ll mol/L的HF和HCN溶液中加NaOH固体调节pH(忽略温度和溶液体积变化),溶液中
(X表示F或者CN)随pH变化情况如图所示,下列说法不正确的是
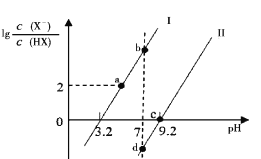
A.直线I对应的是
B.I中a点到b点的过程中水的电离程度逐渐增大
C.c点溶液中:
D.b点溶液和d点溶液相比:cb(Na+)<cd(Na+)
难度: 困难查看答案及解析

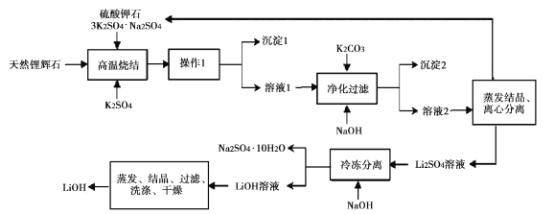
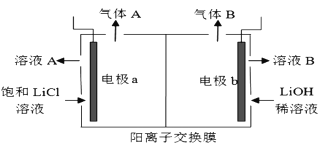

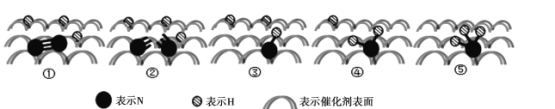
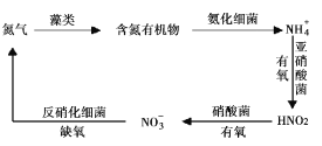
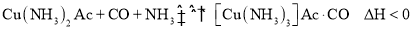 ,生产中必须除去原料气中
,生产中必须除去原料气中