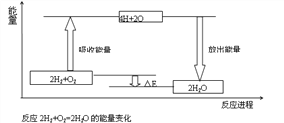
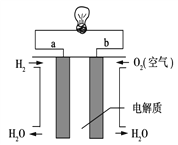
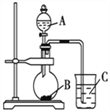
-
下列说法正确的是( )
A.物质发生化学反应时都伴随着能量变化,伴随着能量变化的变化一定是化学变化
B.需要加热的化学反应一定是吸热反应,不需要加热就能进行的反应一定是放热反应
C.等质量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多
D.因为石墨变成金刚石吸热,所以金刚石比石墨稳定
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A.化学键存在所有单质和化合物中
B.化学键的断裂和形成是化学反应能量变化的主要原因
C.只要有能量变化,则一定发生了化学反应
D.当反应物的总能量低于生成物的总能量时,该反应放出能量
难度: 简单查看答案及解析
-
下列物质中,只含有离子键的是
A. KOH B. CO2 C. MgCl2 D. H2O
难度: 简单查看答案及解析
-
1869年,俄国化学家门捷列夫制作出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学发展史上的重要里程碑之一。下列有关我们常用的元素周期表的说法正确的是( )
A.元素周期表有七个横行,也是七个周期
B.元素周期表有18个纵行,即有18个族
C.短周期是指第一、二、三、四周期
D.ⅠA族的元素全部是金属元素
难度: 中等查看答案及解析
-
下列关于化学反应与能量的说法正确的是
A.中和反应是放热反应 B.H2燃烧时的能量变化如图所示
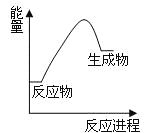
C.化学键断裂放出能量 D.反应物总能量与生成物总能量一定相等
难度: 简单查看答案及解析
-
在盛有稀硫酸的烧杯中,放入用导线连接的铜片和锌片,下列说法正确的是( )
A.负极发生还原反应
B.电子通过导线由铜片流向锌片
C.正极上有氢气逸出,正极电极反应式为:2H++2e-=H2↑
D.负极附近的SO
离子浓度逐渐减小
难度: 简单查看答案及解析
-
如图是元素周期表的一部分,下列关系正确的是( )
A.还原性:Se2->S2->Cl- B.热稳定性:HCl>H2Se>HBr
C.原子半径:Se>Cl>S D.酸性:HBrO4>HClO4>H2SO4
难度: 中等查看答案及解析
-
硒(Se)是第4周期第ⅥA族元素,下列叙述不正确的是( )
A.硒是一种金属性很强的元素
B.硒可以形成SeO2和SeO3
C.硒的氢化物化学式为H2Se
D.硒的最高价氧化物对应水化物的化学式是H2SeO4
难度: 简单查看答案及解析
-
氢化钠(NaH)是一种白色的离子化合物,其中钠元素是+1价;氢化钠与水反应放出氢气,下列叙述中不正确的是( )
A.NaH的电子式为Na+[:H]—
B.NaH与水反应时水作氧化剂
C.NaH中氢元素的离子的电子层排布与氦原子的电子层排布相同
D.半径:H+>H—
难度: 中等查看答案及解析
-
2017年5月9日发布了113号Nh、115号Mc、117号Ts、118号Og这4种新元素的中文名称,下列有关说法正确的是( )
A.115号元素在周期表中的位置是第七周期VB
B.这四种元素都是主族元素
C.118号元素的单质在通常情况下呈气态,其余三种为固态
D.117号元素Ts位于金属非金属分界线上,可能是半导体,与它同族的上一周期元素的原子序数为99
难度: 中等查看答案及解析
-
同周期的X、Y、Z三元素,其最高价氧化物水化物的酸性由弱到强的顺序是:H3ZO4<H2YO4<HXO4,则下列判断正确的是( )
A.原子半径X>Y>Z
B.非金属性X>Y>Z
C.阴离子的还原性按X、Y、Z的顺序由强到弱
D.气态氢化物的稳定性按X、Y、Z的顺序由弱到强
难度: 简单查看答案及解析
-
关于下列图示的说法中正确的是
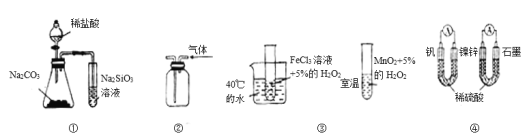
A.用图①所示实验可比较氯、碳、硅三种元素的非金属性强弱
B.用图②所示实验装置通过排空气法收集CO气体
C.图③所示装置可用于探究温度对H2O2分解反应速率的影响
D.图④两个装置中通过导线的电子数相相同时,生成的H2的物质的量也相同
难度: 中等查看答案及解析
-
下列有关实验操作和现象、结论都正确的是( )
选项
实验操作和现象
实验结论
A
常温下,将大小、形状形态的锌和铝分别加入到等体积
的浓硫酸中,观察到前者反应速率快
锌比铝活泼
B
向某溶液中加入盐酸酸化的氯化钡溶液,产生白色沉淀
该溶液中一定含有
C
将盐酸滴入碳酸钠溶液中,产生气泡
非金属性:Cl大于C
D
向某溶液中加入氢氧化钠溶液丙加热,产生的气体能使湿润的红色石蕊试纸变蓝
该溶液中一定含有
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
关于下图所示装置的叙述,正确的是( )
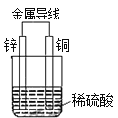
A.氢离子在铜片表面被还原
B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片
D.铜是负极,铜片上有气泡产生
难度: 简单查看答案及解析
-
已知X+Y═M+N为放热反应.下列关于该反应的说法中,正确的是
A. Y的能量一定高于N
B. X、Y的能量总和高于M、N的能量总和
C. 因为该反应为放热反应,故不必加热就可发生
D. 断裂X、Y的化学键所吸收的能量高于形成M、N的化学键所放出的能量
难度: 中等查看答案及解析