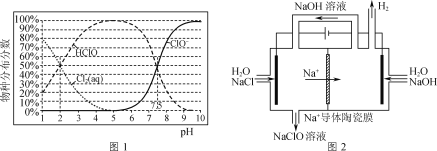
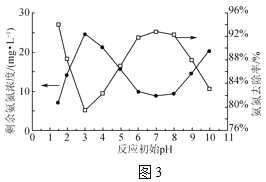
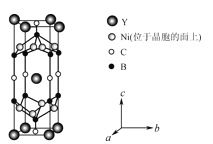
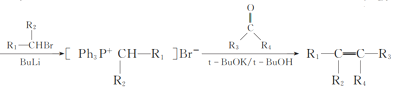-
我国5G技术处于世界领先地位!生产5G芯片的关键材料有高纯硅、氮化镓、超高纯氢氟酸、线型酚醛树脂等。下列说法正确的是( )
A.石英砂用焦炭还原可直接制得高纯硅
B.氮化镓中氮、镓位于周期表中同主族
C.超高纯氢氟酸可用于清洗硅表面SiO2
D.线型酚醛树脂属于天然高分子化合物
难度: 简单查看答案及解析
-
OF2能在干燥空气中迅速发生反应:O2+4N2+6OF2=4NF3+4NO2。下列表示反应中相关微粒的化学用语错误的是( )
A.中子数为10的氧原子:
O
B.氮原子的结构示意图:
C.OF2的结构式:F—O—F
D.NF3的电子式:
难度: 简单查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是( )
A.Al具有导电性,可用于防锈涂料制造
B.NH3具有碱性,可用于生产NH4HCO3
C.Na2O2呈淡黄色,可用于呼吸面具供氧
D.FeCl3易水解,可用于蚀刻铜制线路板
难度: 简单查看答案及解析
-
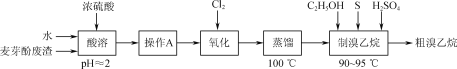
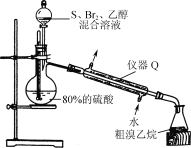
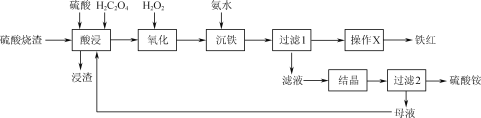
实验室从碘的四氯化碳溶液中分离并得到单质碘,主要步骤为:用浓NaOH溶液进行反萃取(3I2+6OH-=5I-+IO
+3H2O)、分液、酸化(5I-+IO
+6H+=3I2↓+3H2O)、过滤及干燥等。下列有关实验原理和装置不能达到实验目的的是( )
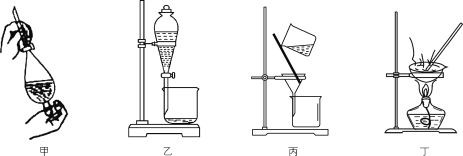
A.用装置甲反萃取时,倒转振荡过程中要适时旋开活塞放气
B.用装置乙分液时,先放出有机相,关闭活塞,从上口倒出水相
C.用装置丙从酸化后的体系中分离出单质碘
D.用装置丁干燥单质碘
难度: 中等查看答案及解析
-
室温下,下列各组离子在指定溶液中能大量共存的是( )
A.能使甲基橙变红的溶液中:Na+、Al3+、Br-、CH3COO-
B.
=1×10-12的溶液中:K+、Na+、CO
、Cl-
C.0.1mol·L-1NaHSO3溶液中:Na+、NH
、ClO-、MnO
D.0.1mol·L-1Fe(NO3)3溶液中:Cu2+、Fe2+、SCN-、SO
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A.Al与NaOH溶液反应:2Al+2OH-+2H2O=2AlO
+3H2↑
B.Fe(OH)2与足量稀硝酸反应:Fe(OH)2+2H+=Fe2++2H2O
C.Na2S碱性溶液中通入SO2生成Na2S2O3:3SO2+S2-=2S2O
D.KMnO4酸性溶液与SO2反应:2MnO
+5SO2+4OH-=2Mn2++5SO
+2H2O
难度: 简单查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.MgCl2(熔融)
Mg(s)
MgO(s)
B.CaC2(s)
C2H4(g)
C.FeS2(s)
SO2(g)
(NH4)2SO4(aq)
D.Al(OH)3(s)
NaAlO2(aq)
AlCl3(aq)
难度: 简单查看答案及解析
-
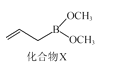
抗菌化合物X可由埃及地中海沿岸采集的沉积物样品中分离得到,其结构简式如图所示。下列有关化合物X的说法正确的是( )
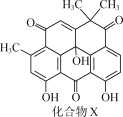
A.分子中有两个手性碳原子
B.分子中所有碳原子位于同一平面
C.能与酸性KMnO4溶液反应
D.1mol化合物X至多与1molBr2发生反应
难度: 简单查看答案及解析
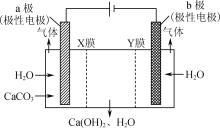
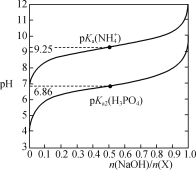
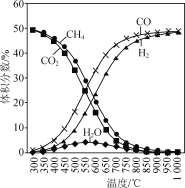
 ;
;