-
下列说法正确的是( )
A.双原子分子中的共价键一定是非极性键
B.任何原子的原子核都是由质子和中子构成的
C.非极性键可能存在于离子化合物中
D.质子数相同的微粒,它们的化学性质基本相同
难度: 简单查看答案及解析
-
在光照条件下,CH4与C12能发生取代反应。若将1molCH4与C12反应,待反应完成后测得四种有机取代物的物质的量之比为:n(CH3Cl):n(CH2Cl2):n(CHCl3):n(CCl4)=4:3:2:l,则消耗的C12为
A.1.0mol B.2.0mol C.3.0mol D.4.0mo1
难度: 中等查看答案及解析
-
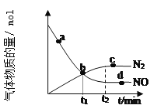
最近日本科学家确认世界还存在着另一种“分子足球”
,它与
分子结构相似,
在高温和撞击后会释放出巨大能量,下列对
的说法不正确的是( )
A.
高温和撞击后应该生成
B.
和
都是氮的同素异形体
C.
中氮原子之间由共价键结合 D.
和
都是氮的同位素
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是( )
A. 甲烷的电子式
B. 乙烷的结构简式:C2H6
C. CH4分子的球棍模型:
D. 核内有8个中子的碳原子:
难度: 中等查看答案及解析
-
A、B是两种前20号元素,A比B的核电荷数少5个,B原子M层比L层电子少2个,则A、B分别是( )。
A.Li、Na B.Na、S C.Na、K D.K、Br
难度: 简单查看答案及解析
-
如图所示是部分短周期元素原子半径与原子序数的关系,则下列说法正确的是( )
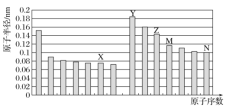
A.Z、N两种元素形成的化合物是离子化合物
B.通过M、N含氧酸的酸性强弱,可以比较两者的非金属性
C.Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液中
D.由X与M两种元素组成的化合物能与水反应
难度: 简单查看答案及解析
-
下列叙述错误的是( )
A. 13C和14C属于同一种元素,它们互为同位素
B. 6Li和7Li的电子数相等,中子数也相等
C. 14C和14N的质量数相等,中子数不相等
D. 1mol
U的中子数比1mol
U的中子数少3NA个
难度: 简单查看答案及解析
-
在常温常压下断裂1 mol指定共价键时吸收的能量如下表:
共价键
C—H
Cl—Cl
C—Cl
H—Cl
吸收的能量/kJ•mol-1
413.4
243
330
436
有关CH4与Cl2反应的下列说法正确的是
A.1mol甲烷生成CCl4最多消耗2mol氯气 B.反应只生成1molCH3Cl时放热109.6kJ
C.反应的有机产物常温下都是液态 D.该反应为放热反应,无需提供能量即可实现
难度: 简单查看答案及解析
-
在一个密闭容器中发生反应:2SO2(g)+O2(g)
2SO3(g)。已知反应过程中的某一时间SO2、O2和SO3的浓度分别为:0.2mol/L、0.1mol/L和0.2mol/L。当反应达到平衡时可能存在的数据正确的是
A.c(O2)=0.2mol/L B.c(SO2)=0.25mol/L
C.c(SO3)=0.4mol/L D.c(SO2)=c(SO3)=0.15mol/L
难度: 简单查看答案及解析
-
对于可逆反应 A(g)+3B(s)
2C(g)+2D(g),在不同条件下的化学反应速率如下, 其中表示的反应速率最快的是
A.v(A)=0.5 mol·L-1·min-1
B.v(B)=1.2 mol·L-1·s-1
C.v(C)=0.1 mol·L-1·s-1
D.v(D)=0.4 mol·L-1·min-1
难度: 简单查看答案及解析
-
分子式为
的烃的一氯代物有( )。
A.3种 B.4种 C.5种 D.6种
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.CHCl3只有一种结构,说明甲烷是以碳原子为中心的正四面体结构
B.甲烷是造成“光化学烟雾”的气体
C.标准状况下,11.2LCCl4中含有C—Cl键的数目为2NA
D.在点燃甲烷气体之前必须检验其纯度
难度: 简单查看答案及解析
-
利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)
CH3OH(g) 反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )
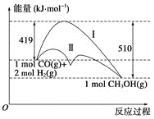
A.生成1mol CH3OH(g)时,该反应吸收的热量为91 kJ。
B.加入催化剂可以减少反应最终放出的热量
C.1mol CO(g)与2molH2(g)的总能量大于1mol CH3OH(g)的总能量
D.如果该反应生成CH3OH (l),则放出的能量会减少
难度: 简单查看答案及解析
-
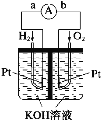
有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验装置
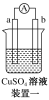
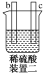
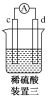
部分实验现象
a极质量减小,b极质量增大
b极有气体产生,c极无变化
d极溶解,c极有气体产生
电流从a极流向d极
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>d B.b>c>d>a
C.d>a>b>c D.a>b>d>c
难度: 中等查看答案及解析
-
X元素原子的质量数为m,核内中子数为n,则w g X+ 含有电子的物质的量是( )
A.(m-n-1)w/m mol B.(m-n)w/m mol
C.(m-n+1)w/m mol D.(m+n)w/m mol
难度: 中等查看答案及解析
-
已知反应2X(g)+Y(g)
Z(g),某研究小组将4moX和2molY置于一容积不变的密闭容器中,测定1min内X的转化率,得到的数据如表所示,下列判断正确的是( )
t/min
2
4.5
5
6
X的转化率
30%
40%
70%
70%
A.随着反应的进行,混合气体的密度不断增大
B.反应在5.5min时,v正(X)=v逆(Z)
C.6min时,容器中剩余1.4 mol Y
D.若反应过程中,容器内压强不再改变,可以说明该反应已达到平衡状态
难度: 简单查看答案及解析
-
少量铁粉与足量的0.1mol•L-1的稀盐酸反应,为了加快此反应速率而不改变H2的产量,可采取的措施有( )
①加H2O ②加NaHSO4固体 ③滴几滴浓盐酸 ④改用 0.3mol•L-1 的HNO3 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度 ⑧改用浓硫酸 .
A.②⑥⑦ B.⑥⑦⑧ C.②③⑦ D.③⑥⑧
难度: 中等查看答案及解析
-
下列物质互为同分异构体的一组是
A.乙烯与乙炔 B.新戊烷与异戊烷 C.12C与14C D.
和
难度: 简单查看答案及解析
-
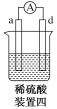
如图所示,电流表指针发生偏转,同时A极质量减少,B极上有气泡产生,C为电解质溶液,
下列说法错误的是
A.B极为原电池的正极
B.A、B、C可能分别为Zn、Cu、稀盐酸
C.C中阳离子向A极移动
D.A极发生氧化反应
难度: 简单查看答案及解析
-
一定温度下,将6 mol A和5 mol B混合,充入2 L密闭容器中,发生反应: 3A(g)+B(g)
xC(g)+2D(g),经5秒钟后生成1 mol D,并测得此时C的浓度为0.5mol•L-1。下列有关叙述正确的是( )
A.此时A的浓度为2 mol·L-1 B.x的值为1
C.B的转化率为20% D.反应速率v(D)=0.1mol•L-1•s-1
难度: 简单查看答案及解析