-
化学与生活息息相关,下列叙述不正确的是( )
A.用活性炭可去除冰箱中的异味
B.单质硅是将太阳能转变为电能的常用材料
C.医用酒精的浓度通常为95%
D.硅胶可用作食品干燥剂
难度: 简单查看答案及解析
-
下列有关化学用语使用正确的是( )
A.NH4Br的电子式:
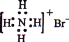
B.S2-的结构示意图:
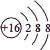
C.酒精的分子式:CH3CH2OH
D.原子核内有l7个中子的氯原子:
Cl
难度: 简单查看答案及解析
-
NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.16gCH4中含有4NA个C−H键
B.标准状况下,22.4L二氯甲烷的分子数约为NA个
C.60g石英晶体所含的氧原子数为4NA
D.1molNa2O2固体中含离子总数为4NA
难度: 简单查看答案及解析
-
在试管中进行下列实验,现象与实验操作不匹配的是( )
实验操作
实验现象
A
向硫酸铜水溶液中逐滴加入氨水
先产生蓝色沉淀,然后溶解,最后得到深蓝色透明溶液
B
向碘水中加入CCl4,振荡、静置
溶液分层,上层为紫红色
C
向FeCl3溶液中加入2滴KSCN溶液
溶液由黄色变为血红色
D
向饱和硼酸溶液中加入Na2CO3溶液
无明显现象
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列关于有机化合物的认识不正确的是( )
A.乙醇与乙酸在一定条件下可发生酯化反应
B.四氯化碳为有机非极性溶剂
C.在水溶液里,乙酸分子中的—CH3可以电离出H+
D.在浓硫酸存在下,苯与浓硝酸共热生成硝基苯的反应属于取代反应
难度: 简单查看答案及解析
-
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R为元素周期表中的电负性最强的元素。则下列判断正确的是( )
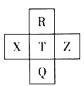
A.非金属性:Z<T<X
B.R与Q的电子数相差24
C.气态氢化物的沸点:R<T<Q
D.最高价氧化物的水化物的酸性:T>Q
难度: 中等查看答案及解析
-
通过NO传感器可监测NO的含量,其工作原理如图所示。下列说法错误的是( )
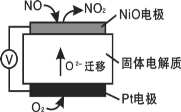
A.该装置可以将化学能转化为电能
B.该电池的总反应为2NO+O2=2NO2
C.NiO电极的电极反应式:NO+O2--2e-=NO2
D.标况下当有2.24LO2参与反应时,转移了0.2mole-
难度: 中等查看答案及解析