-
下列现象与氢键有关的是:
①NH3的熔、沸点比PH3的高 ②小分子的醇、羧酸可以和水以任意比互溶
③冰的密度比液态水的密度小 ④尿素的熔、沸点比醋酸的高
⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低 ⑥水分子高温下也很稳定
A. ①②③④⑤⑥ B. ①②③④⑤ C. ①②③④ D. ①②③
难度: 简单查看答案及解析
-
下列分子中的中心原子杂化轨道的类型相同的是( )
A.CO2与H2O B.CH4与NH3 C.BeCl2与BF3 D.C2H2与C2H4
难度: 中等查看答案及解析
-
下列分子或离子中,含有孤对电子的是( )
A.H2O B.CH4 C.SiH4 D.NH4+
难度: 中等查看答案及解析
-
下列不能形成配位键的组合是 ( )
A.Ag+、NH3 B.BF3、NH3
C.Co3+、CO D.Ag+、H+
难度: 简单查看答案及解析
-
下列物质中,难溶于CCl4的是( )
A.碘单质 B.水 C.苯 D.甲烷
难度: 简单查看答案及解析
-
根据等电子原理,等电子体之间结构相似、物理性质也相近。以下各组粒子不能互称为等电子体的是( )
A.CO和N2 B.O3和SO2
C.CO2和N2O D.N2H4和C2H4
难度: 中等查看答案及解析
-
在具有下列电子排布式的原子中,原子半径最大的是( )
A. 1s22s22p63s23p1 B. 1s22s22p1 C. 1s22s22p3 D. 1s22s22p63s23p4
难度: 中等查看答案及解析
-
元素周期表中,按照第一电离能由大到小顺序排列错误的是( )
A. Be、Mg、Ca B. Mg、Ca、K C. He、Ne、Ar D. O、N、C
难度: 中等查看答案及解析
-
在元素周期表中,同周期的X、Y、Z三种元素,其高价氧化物对应的水化物的酸性强弱顺序是:HXO4>H2YO4>H3ZO4,则下列各判断中正确的是( )
A. 原子半径:X>Y>Z B. 简单阴离子半径:X->Y2->Z3-
C. 气态氢化物稳定性:X<Y<Z D. 电负性:X>Y>Z
难度: 困难查看答案及解析
-
元素周期表中几种短周期元素的原子半径及主要化合价如下表:
元素代号
L
M
X
R
T
原子半径/nm
0.160
0.143
0.102
0.089
0.074
主要化合价
+2
+3
+6,-2
+2
-2
下列叙述正确的是 ( )
①R的氧化物对应的水化物可能具有两性
②X单质可在氧气中燃烧生成XO3
③离子半径大小:r (M3+) < r (T2-)
④L2+和X2-的核外电子数相等
A.①④ B.①③ C.②④ D.①②③
难度: 简单查看答案及解析
-
与卤素单质化学性质相似的物质称为拟卤素或类卤素,如氰气,它的结构式为N≡C—C≡N,下列说法不正确的是 ( )
A.其中叁键的键长比单键要短
B.分子中含3个σ键和4个π键
C.分子构型为直线形
D.可以发生加成反应,但不能与氢氧化钠溶液反应
难度: 简单查看答案及解析
-
最近,中国科大的科学家们将C60分子组装在一单层分子膜表面,在—268℃时冻结分子的热振荡,并利用扫描隧道显微镜首次“拍摄”到能清楚分辨碳原子间单、双键的分子图像。下列化合物分子中一定既含单键又含双键的是 ( )
A.CO2 B.C2H4O C.COCl2 D.H2O2
难度: 简单查看答案及解析
-
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为( )
A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化
B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道
C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强
D.氨气分子是极性分子而甲烷是非极性分子
难度: 简单查看答案及解析
-
根据已有化学知识及经验,判断下列关系中不正确的是 ( )
A.分子的极性大小排序:CH4 < HBr < HCl < HF
B.原子半径大小排序:O < S < Na < K
C.第一电离能大小排序:F > O > N > C
D.电负性排序:F > Cl > S > Se
难度: 简单查看答案及解析
-
由下列物质构成的物质中,同时存在极性键、非极性键和氢键的是 ( )
A.CO2 B.H2O2 C.H2O D.C2H2
难度: 简单查看答案及解析
-
下列说法不正确的是 ( )
A.手性异构体分子组成相同
B.互为手性异构体的分子互为镜像
C.手性异构体性质相同
D.手性催化剂只催化或主要催化一种手性分子的合成
难度: 简单查看答案及解析
-
最近,科学家合成了含有N
的盐类,含有该离子的盐是高能爆炸物质,该离子的结构呈“V”形,如图所示,以下有关该物质的说法中正确的是( )
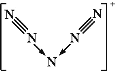
A.每个N
中含有35个质子和36个电子
B.该离子中有非极性键和配位键
C.该离子中含有2个π键
D.与PCl
互为等电子体
难度: 简单查看答案及解析
-
用价层电子对互斥理论预测H2S和NF3的立体结构,两个结论都正确的是 ( )
A.直线形;三角锥形 B.V形;三角锥形
C.直线形;平面三角形 D.V形;平面三角形
难度: 中等查看答案及解析
-
根据杂化轨道理论和价层电子对互斥模型,判断下列分子或者离子的空间构型正确的是 ( )
选项
分子式
中心原子杂化方式
价层电子对互斥模型
分子或离子的立体构型
A
SO2
sp
直线形
直线形
B
H2O
sp2
平面三角形
V形
C
NH3
sp2
三角锥形
三角锥形
D
CH4
sp3
正四面体形
正四面体形
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
三氯化氮(NCl3)是一种淡黄色的油状液体,其分子空间构型与NH3相似。则下面对于NCl3的描述正确的是 ( )
A.是由极性键形成的非极性分子 B.它的挥发性比PBr3要小
C.它还能再以配位键与H+结合 D.Cl—N—Cl的键角是120º
难度: 简单查看答案及解析
-
下列各组分子中,都属于含极性键的非极性分子的是 ( )
A.CO2 H2S B.C2H4 CH4
C.C60 C2H4 D.NH3 HCl
难度: 中等查看答案及解析
-
已知磷酸分子
中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换,又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不再能跟D2O发生氢交换,由此可推断出H3PO2的分子结构是
A.
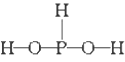 B.
B.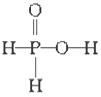 C.
C.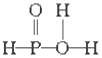 D.
D.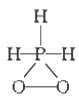
难度: 中等查看答案及解析
 能发生反应:NH3+HCl=NH4Cl。试写出上述氮氢化合物通入足量盐酸时,发生反应的方程式。
能发生反应:NH3+HCl=NH4Cl。试写出上述氮氢化合物通入足量盐酸时,发生反应的方程式。