-
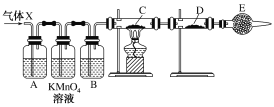
《本草衍义》中对精制砒霜有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。”文中涉及的操作方法是
A. 蒸馏 B. 萃取 C. 升华 D. 结晶
难度: 困难查看答案及解析
-
为了除去粗盐中Ca2+,Mg2+,SO42-及泥沙,将粗盐溶于水,然后进行下列五项操作:①过滤,②加过量的NaOH溶液,③加适量盐酸,④加过量Na2CO3,⑤加过量BaCl2溶液。正确的操作顺序是( )。
A.①④②⑤③ B.④①②⑤③ C.②⑤④③① D.⑤②④①③
难度: 中等查看答案及解析
-
Na2FeO4是一种高效多功能水处理剂,应用前景十分看好。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2 ===2Na2FeO4 +2Na2O+2Na2SO4 +O2↑,对此反应下列说法中正确的是
A.Na2O2只作氧化剂
B.2 mol FeSO4发生反应时,反应中共有8 mol电子转移
C.每生成22.4L氧气就有2 mol Fe2+ 被氧化
D.Na2FeO4既是还原产物又是氧化产物
难度: 困难查看答案及解析
-
化学与人类的生产、生活息息相关,下列说法正确的是( )
A.汽车的排气管上装有“催化转化器”,使有毒的CO和NO反应生成N2和CO2
B.“温室效应”“酸雨”的形成都与氮氧化合物有关
C.大量氯气泄漏时,用氢氧化钠溶液浸湿毛巾捂住嘴和鼻子,并迅速离开现场
D.一定条件下SiO2可与碱和氢氟酸反应,故其属于两性氧化物
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.摩尔是物质的质量的单位 B.氢气的摩尔质量是2g
C.1mo1OH-的质量是17 g D.1mol气体所占的体积一定是22·4L
难度: 简单查看答案及解析
-
下列物质的分类合理的是( )
A.酸性氧化物:SO2、SO3、CO2、CO
B.碱:烧碱、纯碱、苛性钾、氢氧化钡
C.混合物:铝热剂、漂白粉、水煤气、氢氧化铁胶体
D.电解质:稀硫酸、氢氧化钠、氯化钠、MgO
难度: 简单查看答案及解析
-
下列说法中错误的是( )
A.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体
B.“血液透析”利用了胶体的性质
C.明矾能生成Al(OH)3胶体,可用作净水剂
D.用平行光照射NaCl溶液和Fe(OH)3胶体时,产生的现象相同
难度: 简单查看答案及解析
-
下列实验过程中,始终无明显现象的是( )
A.将CO2通入Ba(NO3)2溶液中 B.将NO2通入FeSO4溶液中
C.将NH3通入AlCl3溶液中 D.将SO2通入H2S的溶液中
难度: 简单查看答案及解析
-
设NA代表阿伏加德罗常数,下列说法不正确的是( )
A.1.5 mol NO2与足量的H2O反应,转移的电子数为NA
B.常温常压下,18g D2O含有的原子数为3NA
C.氧气和臭氧的混合物32 g中含有2NA个氧原子
D.在标准状况下,0.5NA个氯气分子所占体积约是11.2 L
难度: 简单查看答案及解析
-
下列各组离子能在溶液中大量共存的是 ( )
A.H+、Fe2+、
、Cl- B.Na+、Ag+、
、Cl-
C.Fe 3+、Na+、
、SCN- D.K+、H+、
、
难度: 简单查看答案及解析
-
下列装置所示的实验中,不能达到实验目的是
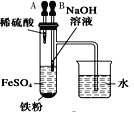
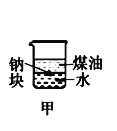
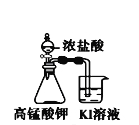
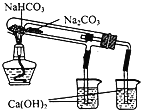
A.长时间看到Fe(OH)2白色沉淀
B.证明ρ(煤油)< ρ(钠) < ρ(水)
C.探究氧化性:
KMnO4>Cl2>I2
D.比较NaHCO3、Na2CO3的热稳定性
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列说法中,正确的是( )
A.硅元素在自然界里均以化合态存在 B.SiO2硬度大,可用于制造光导纤维
C.NH3易溶于水,可用作制冷剂 D.粗硅制备时,发生的反应为C+SiO2= Si +CO2↑
难度: 简单查看答案及解析
-
下列反应的离子方程式正确的是( )。
A.用浓盐酸与二氧化锰反应制取少量氯气:MnO2+4HCl
Mn2+ + 2Cl-+ Cl2↑+2H2O
B.在NaHCO3溶液中滴加少量Ca(OH)2:
+ Ca2+ + OH═ CaCO3↓+ H2O
C.氯气与水反应:Cl2 + H2O ═ 2H+ + Cl- +ClO-
D.NaClO溶液中通入少量的SO2:3ClO﹣+H2O+SO2═Cl﹣+
+2HClO
难度: 中等查看答案及解析
-
关于氮的变化关系图如图:
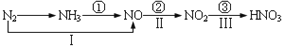
则下列说法不正确的是( )
A.路线①②③是工业生产硝酸的主要途径
B.路线Ⅰ、Ⅱ、Ⅲ是雷电固氮生成硝酸的主要途径
C.上述所有反应都是氧化还原反应
D.上述路线的所有反应中只有I属于氮的固定
难度: 简单查看答案及解析
-
标准状况下,质量相等的下列物质中体积最大的是
A.N2 B.Cl2 C.H2 D.CO2
难度: 简单查看答案及解析
-
对于下列事实的解释错误的是( )
A.浓HNO3与浓HCl按1:3的体积比所得的混合物叫王水
B.浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
C.常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应
D.向碘水中滴加CCl4,振荡静置后分层,下层呈紫红色,说明可用CCl4萃取碘水中的碘
难度: 简单查看答案及解析
-
下列事实与浓硫酸表现出的性质(括号中)对应关系正确的是( )
A.在空气中敞口久置的浓硫酸,溶液质量增大难挥发性
B.在加热条件下铜与浓硫酸反应强氧化性、酸性
C.蔗糖与浓硫酸反应中有海绵状的炭生成吸水性
D.浓硫酸与少量胆矾晶体混合,晶体由蓝色变成白色脱水性
难度: 中等查看答案及解析
-
把铁和铜加入到氯化铁、氯化亚铁和氯化铜的混合溶液中,反应后铁有剩余则
A.溶液中有Fe2+、Cu2+
B.剩下的固体是Fe和Cu
C.溶液中有Fe3+、Fe2+
D.剩下的固体是Fe,无Cu
难度: 中等查看答案及解析
-
现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为 ( )
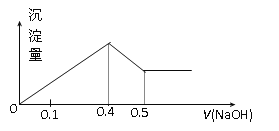
A.1:3 B.2:3
C.6:1 D.3:1
难度: 中等查看答案及解析
-
某溶液中只含有K+、Fe3+、
,已知K+、Fe3+的个数分别为3a和a,则溶液中K+与
的个数比为( )
A.1:4 B.1:2 C.3:4 D.3:2
难度: 简单查看答案及解析
-
将12.8g铜片加入到100mL一定浓度的硝酸溶液中,铜片完全溶解,产生NO和NO2的混合气体4.48L(标准状况下);若向反应后的溶液中加入400mL2mol/LNaOH溶液,能使溶液中的Cu2+恰好完全沉淀.下列说法不正确的是( )
A. 混合气体中NO和NO2的体积之比为1:1 B. 原硝酸溶液的物质的量浓度为10mol/L
C. 铜片与硝酸反应过程中转移电子0.4mol D. 反应后溶液中剩余NO3﹣的物质的量为0.4mol
难度: 困难查看答案及解析