-
法国里昂的科学家最近发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为 “零号元素”。下列有关“四中子”粒子的说法不正确的是( )
A.该粒子不显电性 B.该粒子质量数为 4
C.在周期表中与氢元素占同一位置 D.该粒子质量比氢原子大
难度: 简单查看答案及解析
-
某元素原子 M 层电子数比 K 层电子数多 5 个,该元素的最高正价为
A.+7 B.+5 C.+3 D.无最高正价
难度: 简单查看答案及解析
-
下列说法中正确的是( )
A.化石燃料在任何条件下都能充分燃烧
B.化石燃料在燃烧过程中会产生污染环境的有害气体如CO、SO2等
C.直接燃烧煤和将煤深加工后再燃烧的热效率相同
D.固体煤变为气体燃料后,燃烧效率将降低
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A.因为Na2CO3+SiO2
Na2SiO3+CO2↑,所以硅酸的酸性比碳酸强
B.碳和硅都是ⅣA族的元素,所以二氧化碳和二氧化硅的物理性质相似
C.二氧化硅溶于氢氧化钠溶液又溶于氢氟酸,所以二氧化硅是两性氧化物
D.二氧化硅和二氧化碳都是酸性氧化物,但二氧化硅不和水反应生成硅酸
难度: 简单查看答案及解析
-
银耳本身为淡黄色,某地出产一种雪耳,颜色洁白如雪,其制作过程如下:将银耳堆放在密封状况良好的塑料棚内,在棚的一端支一口锅,锅内放硫黄,加热使硫黄熔化并燃烧,两天左右雪耳就制成了。雪耳炖不烂,且对人体有害,制作雪耳利用的是( )
A.硫的还原性 B.二氧化硫的漂白性 C.二氧化硫的还原性 D.硫的漂白性
难度: 简单查看答案及解析
-
下列粒子半径大小的比较正确的是( )
A.原子半径:
B.原子半径:
C.离子半径:
D.第三周期元素简单离子的半径从左到右逐渐减小
难度: 简单查看答案及解析
-
下列现象或事实不能用同一原理解释的是( )
A.浓硝酸和氯水用棕色试剂瓶保存 B.硫化钠和亚硫酸钠固体长期暴露在空气中变质
C.SO2 和 Na2SO3 溶液都能使氯水褪色 D.常温下铁和铂都不溶于浓硝酸
难度: 简单查看答案及解析
-
下列化学用语表示正确的是
A.中子数为10的氧原子:
O
B.硫化钠的电子式:
C.Mg2+的结构示意图:
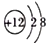
D.HCl 的形成过程:
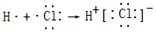
难度: 简单查看答案及解析
-
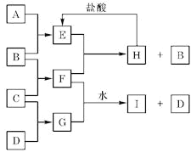
已知
为第Ⅱ
族元素,
为第Ⅲ
族元素,它们的原子序数分别为
和
,且
为同一周期元素,则下列关系错误的是( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
将V1 mL1.00mol·L-1HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL,下列叙述正确的是( )
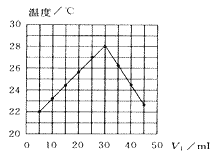
A.做该实验时环境温度为22℃
B.该实验表明化学能可能转化为热能
C.NaOH溶液的浓度约为1.00mol·L-1
D.该实验表明有水生成的反应都是放热反应
难度: 简单查看答案及解析
-
美国科学家发现,普通盐水在无线电波的照射下可燃烧。这一伟大的发现,有望解决用盐水作人类能源的重大问题。无线电频率可以降低盐水中所含元素之间的“结合力”,释放出氢原子,若点火,氢原子就会在该频率下持续燃烧。上述中的“结合力”实质是( )
A.共价键 B.氢键 C.分子间作用力 D.离子键
难度: 简单查看答案及解析
-
研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是
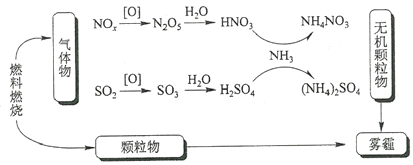
A. 雾和霾的分散剂相同
B. 雾霾中含有硝酸铵和硫酸铵
C. NH3是形成无机颗粒物的催化剂
D. 雾霾的形成与过度施用氮肥有关
难度: 简单查看答案及解析
-
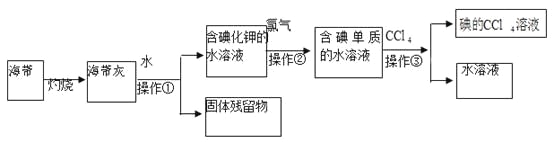
我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务。下列有关海水综合利用的说法不正确的是( )
A.从海水中提炼出的氘(含HDO 0.03‰)进行核聚变,放出巨大的能量以解决能源问题,成为一条新的科学思路,HDO与H2O化学性质相同
B.从海水中提取镁可以采用下列方法:海水
Mg(OH)2
MgCl2溶液→MgCl2·6H2O
MgCl2(熔融)
Mg[
C.从海水获得的碘,可以跟氧气反应生成多种化合物,其中一种称为碘酸碘,在该化合物中,碘元素呈+3和+5两种价态,这种化合物的化学式是I4O9
D.除去粗盐中的SO42 -、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
难度: 中等查看答案及解析
-
在好氧菌和厌氧菌作用下,废液中
能转化为
和
,示意图如下:
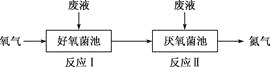
反应Ⅰ
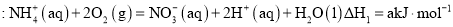
反应Ⅱ
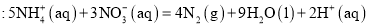
下列说法正确的是( )
A.两池发生的反应中,氮元素只被氧化
B.两池中投放的废液体积相等时,
能完全转化为
C.常温常压下,反应Ⅱ中生成
转移的电子数为
D.
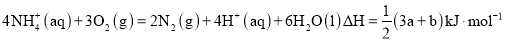
难度: 中等查看答案及解析
-
“封管实验”具有简易、方便、节约、绿色等优点,下列关于四个“封管实验”(夹持装置未画出)的说法正确的是( )
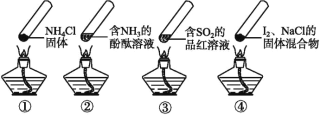
A.加热时,①中上部汇集了 NH4Cl 固体,说明 NH4Cl 的热稳定性比较好
B.加热时,②中溶液变红,冷却后又都变为无色
C.加热时,③中溶液变红,冷却后红色褪去,体现了 SO2 的漂白性
D.加热时,④中上部聚集了固体碘,说明碘的热稳定性较差
难度: 简单查看答案及解析
-
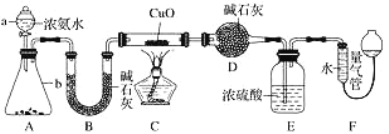
如图所示,利用培养皿探究NH3的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是( )
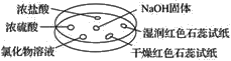
选项
实验现象
解释
A
浓盐酸附近产生白烟
NH3与浓盐酸反应产生了NH4Cl固体
B
浓硫酸附近无明显现象
NH3与浓硫酸不发生反应
C
氯化物溶液变浑浊
该溶液一定是AlCl3溶液
D
干燥红石蕊试纸不变色,湿润红石蕊试纸变蓝
NH3是一种可溶性碱
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
化学反应N2(g)+3H2(g)
2NH3(g)的能量变化如图所示(△E为能量变化值,a、b、c均为正值)。下列相关说法正确的是
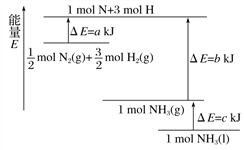
A.此反应为吸热反应
B.1mol N+3mol H中的总能量等于1mol NH3中的能量
C.1mol NH3(l)转变为1mol NH3(g)需要吸收c kJ能量
D.反应N2(g)+3H2(g)
2NH3(g)的能量变化值为a+b
难度: 简单查看答案及解析
-
在100mL混合酸的溶液中,硝酸的物质的量浓度为0.4mol/L,硫酸的物质的量浓度为0.2mol/L,向其中加入6.4g铜粉,微热,使其充分反应,生成NO的物质的量( )
A.0.1mol B.0.02mol C.0.03mol D.0.04mol
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,W原子的最外层电子数为内层电子数的3倍,X在短周期主族元素中金属性最强,Y与W同主族。下列叙述正确的是( )
A.W与X形成的一种化合物可做供氧剂
B.原子半径:r(Z)>r(Y)>r(X)>r(W)
C.简单气态氢化物的热稳定性:W<Z<Y
D.W与氢元素形成的化合物分子中一定不含非极性共价键
难度: 中等查看答案及解析