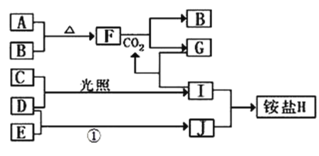
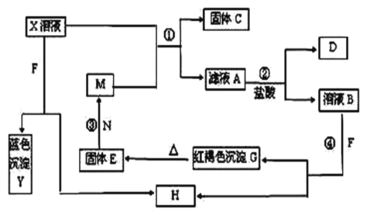
-
下列关于铷(Rb)的叙述正确的是
A. 它位于周期表的第四周期、第ⅠA族 B. 在钠、钾、铷3种单质中,铷的熔点最高
C. 氢氧化铷是弱碱 D. 硝酸铷是离子化合物
难度: 简单查看答案及解析
-
13C-NMR(核磁共振)、15N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构,Kurt Wu thrich等人为此获得2002年诺贝尔化学奖.下面有关13C、15N叙述正确的是
A.13C与15N有相同的中子数 B.13C与C60互为同素异形体
C.15N与14N互为同位素 D.15N的核外电子数与中子数相同
难度: 中等查看答案及解析
-
X元素最高价氧化物对应水化物的化学式为H2XO4,该元素的气态氢化物的化学式是( )
A.HX B.H2X C.XH3 D.XH4
难度: 中等查看答案及解析
-
如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22。下列说法正确的是
X
Y
W
Z
T
A.X、Y、Z三种元素最低价氢化物的沸点依次升高
B.由X、Y和氢三种元素形成的化合物中只有共价键
C.物质WY2、W3X4、WZ4均有熔点高、硬度大的特性
D.T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4
难度: 中等查看答案及解析
-
在元素周期表中金属与非金属的分界线处,可以找到
A.合金 B.半导体材料 C.催化剂 D.农药
难度: 简单查看答案及解析
-
下列物质中,碱性最弱的是
A.NaOH B.KOH C.Mg(OH)2 D.Al(OH)3
难度: 简单查看答案及解析
-
已知下列元素的原子半径
元素
N
S
O
Si
原子半径/10-10m
0.75
1.02
0.74
1.17
根据以上数据,磷原子的半径可能是
A.1.10×10-10m B.1.20×10-10m C.0.80×10-10m D.0.70×10-10m
难度: 简单查看答案及解析
-
下列说法正确的是
A.Ca2+、K+、Cl-、S2-半径依次增大 B.HCl,PH3,H2S稳定性依次减弱
C.NaOH,KOH,CsOH碱性依次减弱 D.Na,Mg,Al还原性依次增强
难度: 简单查看答案及解析
-
下列说法不正确的是
A.Na2O是离子化合物 B.H2O的电子式为H2O的电子式为
C.16gO2含有的原子数为NA D.1mol18O含有的中子数为10NA
难度: 简单查看答案及解析
-
根据元素周期律,由下列事实进行归纳推测,推测不合理的是( )
选项
事实
推测
A
Mg与水反应缓慢,Ca与水反应较快
Ba与水反应会更快
B
Si是半导体材料,同族的Ge也是半导体材料
第ⅣA族的元素的单质都可作半导体材料
C
HCl在1500℃时分解,HI在230℃时分解
HBr的分解温度介于二者之间
D
Si与H2高温时反应,S与H2加热能反应
P与H2在高温时能反应
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
X元素的阳离子与Y的阴离子具有相同的电子层结构,下列叙述正确的是
A.原子半径:X<Y B.原子最外层电子数:X<Y
C.离子半径:X>Y D.原子序数:X<Y
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A.氯化铝溶液中加入过量氨水:Al3++4NH3·H2O=AlO2-+4
+2H2O
B.氯气溶于水:Cl2+H2O=2H++Cl-+ClO-
C.实验室用氯化铵和熟石灰制氨:
+OH-
NH3↑+H2O
D.Cu与足量的浓硝酸:Cu+2
+4H+=Cu2++2NO2↑+2H2O
难度: 中等查看答案及解析
-
以下事实不能用元素周期律解释的是
A.酸性:HClO4>H2SO4 B.热稳定性:Na2CO3>NaHCO3
C.与等浓度的稀盐酸反应,镁比铝剧烈 D.F2在暗处遇H2即爆炸,I2在暗处遇H2几乎无反应
难度: 简单查看答案及解析
-
已知短周期元素甲、乙、丙、丁、戊的原子序数依次增大,其氢化物中甲、乙、丙、戊的化合价如表,下列说法正确的是
元素
甲
乙
丙
戊
化合价
-4
-2
+1
-1
A.原子半径大小:戊>丁>丙>乙
B.气态氢化物稳定性:甲>戊
C.若丁为金属,则丁的最高价氧化物有可能分别与丙、戊的最高价氧化物对应水化物反应
D.若丁为非金属,则最高价氧化物对应水化物酸性强弱:丁>戊
难度: 中等查看答案及解析
-
元素周期表中主族元素左上角与右下角元素性质相似,如Be和Al、B和Si、……,则下列说法错误的是
A.BeO是两性化合物 B.Li2CO3和LiOH均易溶于水
C.1molBe与NaOH溶液反应可生成1molH2 D.已知Si熔沸点高则B熔沸点也高
难度: 中等查看答案及解析
-
下列说法正确的是
A.氯化氢的电子式为
B.Cl-的离子结构示意图为
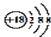
C.AlCl3是离子化合物 D.18g的D216O和H218O具有相同的中子数
难度: 简单查看答案及解析
-
下列物质中既含有离子键又含有共价键的是的是
A.HCl B.KCl C.H2SO4 D.NH4NO3
难度: 简单查看答案及解析
-
如图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是
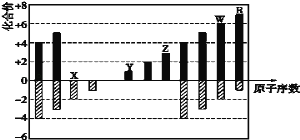
A.氢化物的沸点:H2W<H2X
B.WX3和水反应形成的化合物是离子化合物
C.X,Y,R形成的某种化合物可以用于漂白、消毒
D.Y,Z和W三者最高价氧化物对应的水化物能两两相互反应
难度: 中等查看答案及解析
-
下列说法中正确的是(设NA表示阿伏加德罗常数的值)
A.相同质量的SO2和SO3,含氧原子的个数比为2︰3
B.标准状况下,22.4L水中含有NA个水分子
C.标准状况下,22.4L氦气中含有的原子数为2NA
D.1molNH3和1molCH4所含质子数相等
难度: 中等查看答案及解析
-
下列各图为元素周期表的一部分,表中的数字为原子序数,其中M的原子序数为37的是
A.
B.
C.
D.
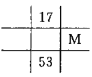
难度: 简单查看答案及解析
-
短周期元素A、B、C的位置如图所示,已知B、C两元素所在族序数之和是A元素所在族序数的2倍,B、C两元素的原子序数之和是A元素的4倍,则A、B、C依次是
A
B
C
A.Be、Na、Al B.C、Al、P
C.O、P、Cl D.B、Mg、Si
难度: 中等查看答案及解析
-
下列关于氯、溴两种元素及其组成的物质的比较中,不正确的是
A.稳定性:HCl<HBr B.非金属性:Cl>Br
C.酸性:HClO4>HBrO4 D.氧化性:Cl2>Br2
难度: 简单查看答案及解析
-
下列物质中,只含非极性共价键的是
A.NaOH B.H2 C.H2S D.NaCl
难度: 简单查看答案及解析
-
甲、乙是元素周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能是 ( )
A.x+2 B.x+4 C.x+8 D.x+18
难度: 简单查看答案及解析