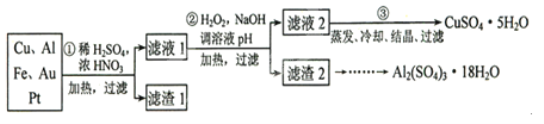
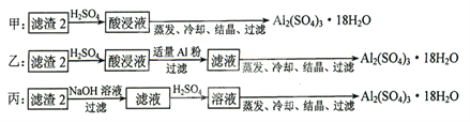
-
下列各组物质的性质比较,正确的是( )
A. 酸性:HClO4>H3PO4>H2SO4 B. 氢化物稳定性:HF>H2O>H2S
C. 碱性:NaOH>Mg(OH)2>Ca(OH)2 D. 原子半径:F>Cl>Br>I
难度: 中等查看答案及解析
-
短周期元素W、X、Y和Z的原子序数依次增大.元素W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍.下列说法错误的是( )
A.元素W、X的氯化物中,各原子均满足8电子的稳定结构
B.元素X与氢形成的原子比为1:1的化合物有很多种
C.元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成
D.元素Z可与元素X形成共价化合物XZ2
难度: 简单查看答案及解析
-
下列有关钢铁腐蚀与防护的说法正确的是
A.钢管与电源正极连接,钢管可被保护
B.铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀
C.钢管与铜管露天堆放在一起,钢管不易被腐蚀
D.钢铁发生析氢腐蚀时,负极反应是Fe-3e-═Fe3+
难度: 中等查看答案及解析
-
在海水浓缩过程中,析出盐的种类和质量见下表(单位g·L-1)。
海水密度
(g·mL-1)
CaSO4
NaCl
MgCl2
MgSO4
NaBr
1.20
0.91
1.21
0.05
3.26
0.004
0.008
1.22
0.015
9.65
0.01
0.04
1.26
0.01
2.64
0.02
0.02
0.04
1.31
1.40
0.54
0.03
0.06
当海水密度达到1.21~1.22 g·mL-1时,析出的盐中,质量分数最大的是( )
A.CaSO4 B.MgSO4
C.NaCl D.MgCl2
难度: 中等查看答案及解析
-
垃圾分类在上海成为新时尚,且还有利于资源回收利用。下列垃圾归类不合理的是( )
A
B
C
D
垃圾
废易拉罐
废塑料瓶
废荧光灯管
蔬菜
垃圾分类
可回收物
其他垃圾
有害垃圾

湿垃圾
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列仪器中,可用酒精灯直接加热的是( )
A.烧杯 B.烧瓶 C.锥形瓶 D.蒸发皿
难度: 简单查看答案及解析
-
由分别与氖和氩电子层结构相同的两种离子组成的化合物是( )
A.MgF2 B.SO2 C.Na2O D.Na2S
难度: 中等查看答案及解析
-
下列氮元素化学用语正确的是
A.氮分子的电子式:
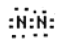 B.氮原子电子排布式:lS22S22p5
B.氮原子电子排布式:lS22S22p5C.氮分子的结构式:
D.氮原子最外层轨道表示式:
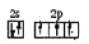
难度: 简单查看答案及解析
-
下列固体混合物与过量的稀H2SO4反应,能产生气泡并有沉淀生成的是( )
A.
和
B.
和NaCl
C.
和
D.
和
难度: 中等查看答案及解析
-
下列物质中一定含有离子的是( )
A.晶体氯 B.铝粉 C.液态氯化氢 D.金刚石
难度: 中等查看答案及解析
-
一定温度下,满足下列条件的溶液一定呈酸性的是( )
A.pH=6的某物质的水溶液 B.加酚酞后显无色的溶液
C.能与金属Al反应放出H2的溶液 D.c(H+)>c(OH-)的任意物质的水溶液
难度: 简单查看答案及解析
-
下列物质的转化在给定条件下能实现的是( )
①
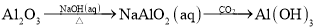
②
③
④
A.①③ B.①④ C.②③ D.②④
难度: 中等查看答案及解析
-
化学无处不在,与化学有关的说法不正确的是 ( )
A.侯氏制碱法的工艺过程中应用了物质溶解度的差异
B.可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气
C.碘是人体必需微量元素,所以要多吃富含高碘酸的食物
D.黑火药由硫磺、硝石、木炭三种物质按一定比例混合制成
难度: 简单查看答案及解析
-
2,2-二甲基-3-乙基“某烷”,该烷烃的碳至少为( )
A.5个 B.8个 C.9个 D.10个
难度: 中等查看答案及解析
-
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn,发生反应:Sn(s)+Pb2+(aq)
Sn2+(aq)+Pb(s),体系中c(Pb2+)、c(Sn2+)变化关系如图所示。下列判断正确的是( )
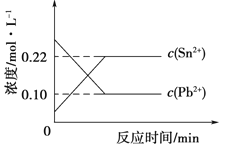
A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应正反应是吸热反应
D.25℃时,该反应的平衡常数K=2.2
难度: 中等查看答案及解析
-
科学家最近研究出一种环保、安全的储氢方法,其原理可表示为:
NaHCO3+H2
HCOONa+H2O下列有关说法正确的是
A.储氢、释氢过程均无能量变化
B.NaHCO3、HCOONa均含有离子键和共价键
C.储氢过程中,NaHCO3被氧化
D.释氢过程中,每消耗0.1molH2O放出2.24L的H2
难度: 简单查看答案及解析
-
新鲜水果、蔬菜、乳制品中富含的维生素C具有明显的抗衰老作用,但易被空气氧化。某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式为:
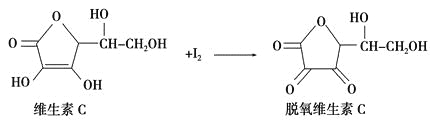 +2HI
+2HI下列认识正确的是( )
A.上述反应为取代反应 B.滴定时可用淀粉溶液作指示剂
C.滴定时要剧烈振荡锥形瓶 D.维生素C的分子式为C6H9O
难度: 中等查看答案及解析
-
有一瓶Na2SO3溶液,由于它可能部分被氧化,某同学进行如下实验:取少量溶液,滴入Ba(NO3)2溶液,产生白色沉淀,再加足量稀硝酸,充分振荡后,仍有白色沉淀,对此实验下述结论正确的是
A.Na2SO3已部分被氧化
B.加入Ba(NO3)2溶液后,生成的沉淀中一定含有BaSO4
C.加硝酸后的不溶沉淀一定是BaSO4和BaSO3
D.此实验不能确定Na2SO3是否部分被氧化
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.向NaAlO2溶液中通入过量CO2:
B.铝与氯化铜溶液反应:
C.次氯酸钙溶液中通入SO2气体:
D.在溶液中NH4HCO3与NaOH以等物质的量混合:
难度: 中等查看答案及解析
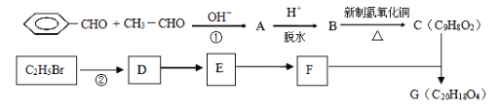
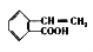 的2种同分异构体(同时含碳碳双键、苯环和羧基)__________。
的2种同分异构体(同时含碳碳双键、苯环和羧基)__________。 _______________。
_______________。