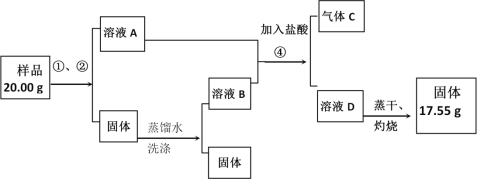
-
在 KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O 的反应中,被还原与被氧化的氯原子数之比是
A.6:1 B.1:6 C.5:1 D.1:5
难度: 简单查看答案及解析
-
下列有关物质分离或提纯方法的叙述中,不正确的是( )
A.用酒精萃取碘水中的碘
B.用蒸馏的方法将自来水制成蒸馏水
C.用溶解、过滤的方法分离硝酸钾和沙子
D.用加热的方法分离氯化钠和氯化铵固体
难度: 中等查看答案及解析
-
在0.5molNa2SO4中含有Na+的数目是( )
A.3.01×1023 B.6.02×1023 C.0.5 D.1
难度: 简单查看答案及解析
-
下列仪器中,不能用于加热的是( )
A.容量瓶 B.试管 C.蒸发皿 D.烧杯
难度: 简单查看答案及解析
-
摩尔是( )
A.物质的质量单位 B.物质的量 C.6.02×1023个微粒 D.物质的量的单位
难度: 简单查看答案及解析
-
在水溶液里或熔融状态下能导电的化合物是电解质。下列物质不属于电解质的是
A.Fe B.NaOH C.H2SO4 D.Na2SO4
难度: 简单查看答案及解析
-
当光束通过下列分散系时,可观察到丁达尔效应的是
A.乙醇溶液 B.氯化钠溶液
C.硫酸铜溶液 D.氢氧化铁胶体
难度: 中等查看答案及解析
-
目前人类已发现几千万种物质,对物质进行分类,有利于我们的学习。下列关于物质的类别中,不正确的是(括号内为类别)( )
A.H2O(氧化物) B.H2SO4(含氧酸)
C.CH3COOH(混合物) D.I2的CCl4溶液(混合物)
难度: 简单查看答案及解析
-
下列各组混合物中,能用分液漏斗进行分离的是( )
A.碘和四氯化碳 B.水和四氯化碳
C.酒精和水 D.汽油和植物油
难度: 简单查看答案及解析
-
将5mL10mol/L的H2SO4稀释到100mL,所得硫酸溶液的物质的量浓度是( )
A.0.2mol/L B.2mol/L C.0.5mol/L D.5mol/L
难度: 简单查看答案及解析
-
下列行为中符合安全要求的是( )
A.进入煤矿井时,用火把照明
B.实验时,将水倒入浓硫酸配制稀硫酸
C.用点燃的火柴在液化气钢瓶口检验是否漏气
D.节日期间,在开阔的广场燃放烟花爆竹
难度: 简单查看答案及解析
-
关于SO2气体的叙述中,正确的是( )
A. SO2的摩尔质量是64 g
B. 1mol SO2中所含分子数约为6.02×1023
C. 1 mol SO2的质量是64 g·mol-1
D. 25℃,1.01×105Pa下,1 mol SO2的体积为22.4 L
难度: 中等查看答案及解析
-
下列化学方程式不能用H++OH-=H2O表示的是
A.KOH+HCl=KCl+H2O
B.Ba(OH)2+2HCl=BaCl2+2H2O
C.2NaOH+H2SO4=Na2SO4+2H2O
D.Cu(OH)2+2HNO3=Cu(NO3)2+2H2O
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数。下列说法正确的是( )
A.1molNa2SO4溶于水,所得溶液中Na+的数目为NA
B.17gNH3中含有质子的数目为10NA
C.标准状况下,22.4LH2O含有氢原子的数目为2NA
D.11.2LH2含有氢原子的数目为NA
难度: 简单查看答案及解析
-
下列物质与危险化学品标志的对应关系不正确的是( )
A
B
C
D
乙醇
天然气
浓硫酸
氢氧化钠

A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列反应中,属于氧化还原反应的是
A.2 H2O2
2 H2O + O2↑ B.2 Al(OH)3
Al2O3 + 3 H2O
C.FeO + 2 HCl = FeCl2+ H2O D.CuCl2+ 2 NaOH = Cu(OH)2↓+ 2NaCl
难度: 简单查看答案及解析
-
下列溶液中,溶质的物质的量浓度最大的是( )
A.250mL2mol/L的NaOH溶液 B.500mL1mol/L的盐酸
C.100mL3mol/L的硫酸 D.40mL5mol/L的盐酸
难度: 简单查看答案及解析
-
用NaOH固体配制一定物质的量浓度的NaOH溶液,下列操作中正确的是( )
A.称量时,将固体NaOH直接放在天平右盘上
B.将称量好的固体NaOH放入容量瓶中,加蒸馏水溶解
C.将烧杯中溶解固体NaOH所得溶液,冷却到室温后转移至容量瓶中
D.定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分
难度: 简单查看答案及解析
-
14gN2的物质的量为( )
A.14mol B.0.5mol C.2mol D.1mol
难度: 简单查看答案及解析
-
在2Cu(NO3)2
2CuO+4NO2↑+O2↑反应中,被氧化的元素是( )
A.Cu B.N C.O D.Cu和O
难度: 简单查看答案及解析
-
下列应用与胶体的性质没有关系的是( )
A.用明矾净化饮用水
B.用石膏或盐卤制豆腐
C.向FeCl3溶液中加入NaOH溶液,生成红褐色沉淀
D.一束光线照射淀粉溶液,可看到光亮的通路
难度: 简单查看答案及解析
-
下列化学反应中,不属于四种基本反应类型的是( )
A.2HCl+CaCO3=CaCl2+H2O+CO2↑ B.2FeCl3+Cu=2FeCl2+CuCl2
C.2KMnO4
K2MnO4+MnO2+O2↑ D.Na2O+H2O=2NaOH
难度: 简单查看答案及解析
-
下列装置能达到对应实验目的的是( )
选项
A
B
C
D
装置
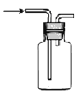
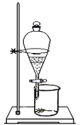
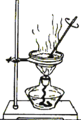
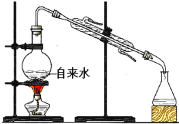
目的
收集H2
分离碘和泥沙
分离水和四氯化碳
实验室制取蒸馏水
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列各组离子,能在无色透明的强酸性溶液中大量共存的是( )
A.K+、Na+、NO
、Fe3+ B.Mg2+、Na+、Cl-、SO42-
C.K+、Na十、Br-、Cu2+ D.Na+、Ba2+、OH-、SO42-
难度: 简单查看答案及解析
-
某无色溶液可能含有AgNO3、NaCl、Na2CO3和Na2SO4中的一种。取少量该溶液于试管中,加入稀盐酸,无明显现象,再加入BaCl2溶液,有白色沉淀产生。则该物质是( )
A.AgNO3 B.NaCl C.Na2SO4 D.Na2CO3
难度: 简单查看答案及解析
-
等质量的下列物质中,所含分子数最少的是( )
A.Cl2 B.NH3 C.HCl D.H2SO4
难度: 简单查看答案及解析
-
在相同条件下,两种气体的物质的量相同,下列说法正确的是( )
A.体积均为22.4L B.具有相同的原子数目
C.具有相同的质量 D.具有相同的体积
难度: 简单查看答案及解析
-
下列电离方程式中,不正确的是( )
A.HCl=H++Cl- B.Na2SO4=Na++ SO42−
C.NaHCO3=Na++ HCO3- D.NaHSO4=Na++ SO42−+H+
难度: 简单查看答案及解析
-
下列离子方程式正确的是( )
A.氧化镁与稀硫酸混合:MgO+2H+=Mg2++H2O
B.稀硫酸滴在铜片上:Cu+2H+=H2↑+Cu2+
C.向稀盐酸溶液中加铁:3Fe+6H+=3Fe3++3H2↑
D.稀盐酸滴在石灰石上:CaCO3+2H+=Ca2++H2CO3
难度: 简单查看答案及解析
-
瓦斯中甲烷与氧气的质量比为1∶4时极易爆炸,此时甲烷与氧气的体积比为( )
A.1∶4 B.2∶1 C.1∶1 D.1∶2
难度: 简单查看答案及解析
-
吸入人体內的氧有2%转化为氧化性极强的“活性氧”,它能加速人体衰老,被称为“生命杀手”,服用含硒元素(Se)的化合物亚硒酸钠(Na2SeO3),能消除人体內的活性氧,由此推断Na2SeO3在人体中的作用是( )
A.作氧化剂 B.作还原剂
C.既作氧化剂又作还原剂 D.既不作氧化剂又不作还原剂
难度: 简单查看答案及解析
-
设NA代表阿伏加德罗常数,下列说法正确的是( )
A.5.6g金属铁与足量稀盐酸充分反应,失去的电子数为0.3NA
B.常温常压下,9gH2O中含有的分子数为NA
C.标准状况下,11.2LCO2中含有的氧原子数为NA
D.常温常压下,0.1mol氖气所含的电子数为2NA
难度: 中等查看答案及解析