-
有A、B、C、D四种金属。将A与B用导线连接起来,浸入电解质溶液中,B为正极。将A、D分别投入等浓度盐酸中,D比A反应剧烈。将铜浸入B的盐溶液里,无明显变化。如果把铜浸入C的盐溶液里,有金属C析出。据此判断它们的活动性由强到弱的顺序是( )
A.DCAB B.DBAC C.DABC D.BADC
难度: 简单查看答案及解析
-
过量的锌粉与一定量的稀盐酸反应,为了减慢反应速率,但是又不影响生成的氢气总量,可以采取的措施是
A.升高温度 B.加入适量的水 C.加入少量CuSO4溶液 D.加入浓度较大的盐酸
难度: 简单查看答案及解析
-
下列四种盐酸溶液,均能跟锌片反应,其中最初反应速率最快的是( )
A.10℃20mL3mol/L的盐酸溶液 B.20℃30mL2mol/L的盐酸溶液
C.20℃20mL2mol/L的盐酸溶液 D.20℃10mL4mol/L的盐酸溶液
难度: 简单查看答案及解析
-
决定化学反应速率的主要因素是( )
A. 参加反应物本身的性质 B. 催化剂
C. 温度和压强以及反应物的接触面 D. 反应物的浓度
难度: 简单查看答案及解析
-
元素性质呈现周期性变化的根本原因是 ( )
A.元素的相对原子质量递增,量变引起质变
B.元素原子的核外电子排布呈周期性变化
C.元素的原子半径呈周期性变化
D.元素的化合价呈周期性变化
难度: 简单查看答案及解析
-
下列化学电池不易造成环境污染的是
A.氢氧燃料电池 B.锌锰电池
C.镍镉电池 D.铅蓄电池
难度: 简单查看答案及解析
-
下列反应既属于氧化还原反应,又属于吸热反应的是( )
A.锌粒与稀硫酸的反应
B.灼热的木炭与CO2反应
C.甲烷在氧气中的燃烧反应
D.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
难度: 简单查看答案及解析
-
下列递变情况中,正确的是
A.Na、Mg、Al原子的最外层电子数依次减少
B.Si、P、S元素的最高正价依次降低
C.C、N、O的原子半径依次减小
D.Li、Na、K的金属性依次减弱
难度: 简单查看答案及解析
-
下列各组粒子中属于同位素的是
A.16O和18O B.H2O和D2O C.H2和D2 D.24Mg和24Na
难度: 简单查看答案及解析
-
某微粒用 AZQn+表示,下列关于该微粒的叙述正确的是( )
A.所含质子数=A-n B.所含中子数=A-Z
C.所含电子数=Z+n D.质量数=Z+A
难度: 简单查看答案及解析
-
下列物质中,既含有离子键又含有共价键的是( )
A.HCl B.KOH C.CaCl2 D.CO2
难度: 简单查看答案及解析
-
已知同周期X、Y、Z三种元素的最高价氧化物对应水化物酸性由强到弱的顺序为HXO4>H2YO4>H3ZO4,则有关X、Y、Z下列判断中正确的是( )
A.气态氢化物的稳定性按X、Y、Z的顺序增强
B.原子半径按X、Y、Z的顺序减小
C.元素非金属性按X、Y、Z的顺序减弱
D.单质的氧化性按X、Y、Z的顺序增强
难度: 中等查看答案及解析
-
在周期表中金属和非金属的分界线附近能找到( )
A.制农药的元素 B.制催化剂的元素
C.制耐高温合金材料的元素 D.做半导体的元素
难度: 简单查看答案及解析
-
实际存在的
H、
H、
H、H和H2,它们是( )
A.氢元素的五种不同微粒 B.五种氢元素
C.氢的五种原子 D.氢的五种同位素
难度: 简单查看答案及解析
-
下列各组性质的比较中正确的是( )
A.酸性HClO4<HBrO4<HIO4
B.碱性Ba(OH)2>Ca(OH)2>Mg(OH)2
C.稳定性HCl>PH3>H2S
D.还原性Cl->Br->I-
难度: 简单查看答案及解析
-
短周期元素X、Y、Z、W的原子序数依次增大,X 原子的最外层电子数是其内层电子总数的3 倍,Y 原子的最外层只有2 个电子,Z 单质可制成半导体材料,W与X属于同一主族。下列叙述正确的是( )
A.元素X 的简单气态氢化物的热稳定性比W 的弱
B.元素W 的最高价氧化物对应水化物的酸性比Z 的弱
C.化合物YX、ZX2、WX3 中化学键的类型相同
D.原子半径的大小顺序: rY>rZ>rW>rX
难度: 中等查看答案及解析
-
下列有关化学用语使用不正确的是( )
A.NH4Br的电子式:
 B.S2-的结构示意图:
B.S2-的结构示意图: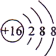
C.H2的结构式:H-H D.原子核内有18个中子的氯原子:
难度: 简单查看答案及解析
-
X、Y都是短周期元素,X原子最外层只有一个电子,Y元素的最高正价与最低负价的代数和为6,X和Y两元素形成的化合物为R,则下列关于R的叙述正确的是( )
A.R一定是共价化合物 B.R一定是离子化合物
C.R可能是共价化合物,也可能是离子化合物 D.R一定是气态物质
难度: 中等查看答案及解析
-
A、B、C三种元素的原子序数依次为a、b、c,它们的离子An+、Bn-、Cm-具有相同的电子层结构,且n > m ,则下列关系正确的是( )
A.a > b > c B.a > c > b
C.a = b + m + n D.a = c – n - m
难度: 中等查看答案及解析
-
有X、Y两种原子,X原子的L电子层比Y原子的L电子层少3个电子,Y原子的核外电子数比X原子的电子数总数多5个,则X,Y元素的元素符号分别为( )
A.C和Al B.N和Be C.Si和B D.N和Mg
难度: 中等查看答案及解析
-
下列变化过程,吸热的是( )
A.H+H→H2 B.H+Cl→HCl C.I2→I+I D.S+O2→SO2
难度: 简单查看答案及解析
-
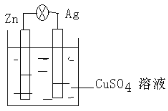
下列各个装置中能组成原电池的是
A.
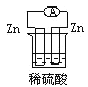 B.
B.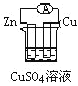
C.
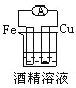 D.
D.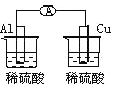
难度: 中等查看答案及解析
-
对于原电池的电极名称,下列叙述有错误的是( )
A.发生氧化反应的为负极 B.正极为电子流入的一极
C.比较不活泼的金属为负极 D.正极为电解质溶液中阳离子移向的一极
难度: 简单查看答案及解析
-
对于锌-铜-稀硫酸组成的原电池装置中,当导线中有1mol电子通过时,理论上的两极变化是: ①锌片溶解了32.5g;②锌片增重了32.5g;③铜片上析出1gH2;④铜片上析出1mol H2;
A. ①和③ B. ①和④ C. ②和③ D. ②和④
难度: 中等查看答案及解析
-
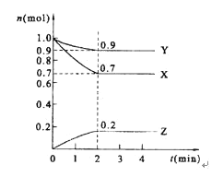
对于可逆反应:M+N
Q达到平衡时,下列说法正确的是( )
A.M、N、Q三种物质的浓度一定相等
B.M、N全部变成了Q
C.反应中混合物各成分的百分组成不再变化
D.反应已经停止
难度: 中等查看答案及解析