-
现有四种元素的基态原子的电子排布式如下:①1s22s22p63s23p4 ,②1s22s22p63s23p3,③1s22s22p3,④1s22s22p5,则下列有关比较中正确的是
A.原子半径:④>③>②>① B.第一电离能:④>③>②>①
C.电负性:④>③>②>① D.最高正化合价:④>③=②>①
难度: 中等查看答案及解析
-
下列说法中正确的是
A.P4、CS2、PH3都是非极性分子
B.金刚石和C60都是原子晶体
C.aXm﹣和bYn﹣是电子层结构相同的短周期元素的离子,若n>m,则原子半径X>Y
D.短周期元素的最高价氧化物对应的水化物的碱性:M(OH)m>N(OH)n,则离子氧化性:Mm+<Nn+
难度: 简单查看答案及解析
-
碳、硫、氧、氮是中学常见元素,下列说法正确的是( )
A.CO2、SO2、NH3都是直线形分子
B.CO2、H2O、NH3的键角依次减小
C.H2O2、N2H4分子的中心原子都是sp3杂化
D.C、N、F元素的电负性依次减小
难度: 简单查看答案及解析
-
下列推论正确的是( )
A.SiH4的沸点高于CH4,可推测PH3的沸点高于NH3
B.CO2晶体是分子晶体,可推测SiO2晶体也是分子晶体
C.NH4+为正四面体结构,可推测PH4+也为正四面体结构
D.C2H6是碳链为直线型的非极性分子,可推测C3H8也是碳链为直线型的非极性分子
难度: 中等查看答案及解析
-
现在含有元素硒(Se)的保健品已经进入市场。已知硒与氧元素同族,与钾元素同周期。下列关于硒的说法不正确的是( )
A.原子最外层电子排布式为4s24p4
B.最高价氧化物对应水化物的化学式为H2SeO4
C.Br的非金属性比Se弱
D.O和Se为p区元素,K为s区元素
难度: 简单查看答案及解析
-
下列各离子或原子的电子排布式错误的是( )
A.Ca2+:1s22s22p63s23p6 B.Fe3+:1s22s22p63s23p63d5
C.K:1s22s22p63s23p64s1 D.O2-:1s22s22p4
难度: 简单查看答案及解析
-
气态中性基态原子的原子核外电子排布发生如下变化,吸收能量最多的是( )
A.1s22s22p63s23p2→1s22s22p63s23p1
B.1s22s22p63s23p3→1s22s22p63s23p2
C.1s22s22p63s23p4→1s22s22p63s23p3
D.1s22s22p63s23p63d104s24p2→1s22s22p63s23p63d104s24p1
难度: 中等查看答案及解析
-
下列事实与氢键有关的是( )
A.水加热到很高的温度都难以分解
B.水结成冰体积膨胀,密度变小
C.HF、HCl、HBr、HI的热稳定性依次减弱
D.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高
难度: 中等查看答案及解析
-
下列各分子中所有原子都满足最外层8电子稳定结构且共用电子对发生偏移的是
A.BeCl2 B.PCl3 C.PCl5 D.N2
难度: 中等查看答案及解析
-
已知氯化铝易溶于苯和四氯化碳,其熔点为190℃,则下列结论错误的是
A.氯化铝是电解质 B.固体氯化铝是分子晶体
C.可用电解熔融氯化铝的办法制取金属铝 D.氯化铝为非极性分子
难度: 中等查看答案及解析
-
已知X、Y是主族元素,I为电离能,单位是kJ/mol。根据下表所列数据判断错误的是
元素
I1
I2
I3
I4
X
496
4562
6912
9543
Y
578
1817
2745
11600
A.元素X的常见化合价是+1价
B.元素X与氯形成化合物时,化学式为XCl
C.元素Y是ⅢA族的元素
D.若元素Y处于第3周期,它可与冷水剧烈反应
难度: 中等查看答案及解析
-
下列叙述错误的是( )
①热稳定性:H2O>HF>H2S ②熔点:Al>Na>K ③ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布 ④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素⑤多电子原子中,在离核较近的区域内运动的电子能量较高 ⑥盐酸可与碳酸钠溶液反应生成CO2气体,说明盐酸比碳酸强,则Cl 比S的非金属性强 ⑦SiCl4、PCl3分子中各原子最外层均达到8电子稳定结构。
A.①③⑤⑥ B.②④⑥ C.②③④⑦ D.①⑤⑥
难度: 简单查看答案及解析
-
下列说法正确的是
A.只含有一种元素的物质一定是纯净物
B.含有共价键的化合物一定是共价化合物
C.石墨转变为金刚石为化学变化
D.水很稳定是因为水分子间存在较强的分子间作用力
难度: 中等查看答案及解析
-
下列说法正确的是
A.乙醇中的—OH上的氢比水分子中的—OH上的氢活泼
B.[TiCl(H2O)5]Cl2·H2O的配合物内界和外界Cl-的数目之比是1∶2
C.氯的各种含氧酸的酸性由强到弱排列为HClO4<HClO3<HClO2<HClO
D.手性分子CH2=CHCH(CH2OH)COOH与足量的H2反应后分子有两个手性碳原子
难度: 中等查看答案及解析
-
下列说法正确的是
A.原子最外层电子数为2的元素一定处于周期表的第IIA族
B.H2O比H2S稳定是因为H2O分子间有氢键
C.离子化合物中可能含有共价键
D.因为盐酸的酸性比氢硫酸(H2S水溶液)强,所以非金属性:Cl﹥S
难度: 中等查看答案及解析
-
下列有关表述正确的是( )
A.次氯酸的电子式:
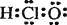
B.N原子的电子排布图为:

C.硫原子的价电子排布式:3s23p4
D.二氧化硅的分子式:SiO2
难度: 简单查看答案及解析
-
如图是元素周期表中关于碘元素的信息,其中解读正确的是( )
A.碘原子的中子数为53
B.碘原子核外电子数为127
C.碘原子核外有5种不同能量的电子
D.碘原子最外层有7种不同运动状态的电子
难度: 简单查看答案及解析
-
可利用反应2Cr2O72-+3CH3CH2OH+16H++13H2O→4[Cr(H2O)6]3++3CH3COOH检测乙醇。下列说法错误的是( )
A.基态Cr3+的核外电子排布式为3d3
B.[Cr(H2O)6]3+中与Cr3+形成配位键的原子是氧原子
C.CH3COOH分子中含有7个
键
D.已知CrO42-是以Cr为中心的四面体结构,则Cr2O72-结构中含有两个四面体
难度: 中等查看答案及解析
-
美国化学家鲍林教授具有独特的化学想象力:只要给他物质的分子式,他就能大体上想象出这种物质的分子结构模型.多核离子所带电荷可以认为是中心原子得失电子所致,根据VSEPR模型,下列离子中所有原子都在同一平面上的一组是( )
A.NO
和NH
B.H3O+和ClO
C.NO
和CO
D.PO
和SO
难度: 中等查看答案及解析
-
[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:4HCHO+[Zn(CN)4]2−+4H++4H2O= [Zn(H2O)4]2++4HOCH2CN,HOCH2CN的结构简式如图所示,下列说法不正确的是( )

A.HOCH2CN分子中没有手性碳原子
B.1mol HOCH2CN分子中含有σ键的物质的量为5mol
C.[Zn(CN)4]2-和[Zn(H2O)4]2+的中心原子配位数均为4
D.HOCH2CN分子中碳原子轨道的杂化类型分别是sp3和sp杂化
难度: 中等查看答案及解析
-
以下微粒含配位键的是( )
①N2H5+ ②CH4 ③OH- ④NH4+ ⑤Fe(CO)5 ⑥Fe(SCN)3 ⑦H3O+ ⑧[Ag(NH3)2]OH
A. ①②④⑦⑧ B. ③④⑤⑥⑦
C. ①④⑤⑥⑦⑧ D. 全部
难度: 中等查看答案及解析
-
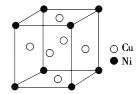
某晶体由M、N两种原子构成,其晶胞如图所示。实心球•表示N原子,空心球○表示M原子,则它的化学式为( )
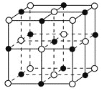
A.M4N4 B.M14N13 C.MN D.M4N5
难度: 简单查看答案及解析
-
下图为甲烷晶体的晶胞结构,下列有关说法正确的是( )
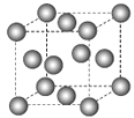
A.甲烷晶胞中的球体只代表一个碳原子
B.晶体中1个
分子有12个紧邻的甲烷分子
C.
晶体熔化时需克服共价键
D.一个甲烷晶胞中含有8个
分子
难度: 简单查看答案及解析