-
化学点亮生活,下列对生活中的化学理解正确的是
A. 节日燃放的烟花,是碱金属、锶、钡、铂、铁等金属元素焰色反应呈现的
B. 古代合成颜料中国蓝的化学式为BaCuSi4O10,可改写成BaO·CuO·4SiO2
C. MnO2有较强的氧化性,可作H2O2分解的氧化剂
D. 赏心悦目的雕花玻璃是使用烧碱对玻璃刻蚀而成的
难度: 简单查看答案及解析
-
在一定量铁的氧化物中,加入45 mL4 mol/L硫酸溶液恰好完全反应,所得溶液中Fe2+能恰好被标准状况下672mL氯气氧化。则该固体中铁原子和氧原子的个数之比为
A. 5:6 B. 7:9 C. 3:4 D. 2:3
难度: 困难查看答案及解析
-
用化学用语表示Na2CO3+2Cl2===2NaCl+Cl2O+CO2中的相关微粒,其中正确的是( )
A.Na+的结构示意图:
B.Cl2O的结构式:Cl—O—Cl
C.中子数比质子数多3的氯原子:3517Cl
D.CO2的电子式:
难度: 中等查看答案及解析
-
实现下列变化时,需克服相同类型作用力的是( )
A.水晶和干冰的熔化 B.食盐和冰醋酸熔化
C.液溴和金刚石的气化 D.纯碱和烧碱的熔化
难度: 简单查看答案及解析
-
下列离子方程式中正确的是
A.用惰性电极电解CuCl2溶液:Cu2++2Cl-+2H2O
Cu(OH)2↓+H2↑+Cl2↑
B.向FeBr2溶液中通入过量Cl2:2Fe2++4Br﹣+2Cl2=2Fe3++2Br2+4Cl﹣
C.向硫酸氢钾溶液中加入Ba(OH)2溶液至中性:2H++ SO42-+Ba2++2OH﹣=BaSO4↓+2H2O
D.NH4HCO3溶液与过量NaOH溶液反应:NH4+ +OH﹣=NH3↑+H2O
难度: 中等查看答案及解析
-
在25℃时,将1.0L c mol·L-1 CH3COOH溶液与0.1mol NaOH固体混合,使之充分反应。然后向该混合溶液中通入HCl气体或加入NaOH固体(忽略体积和温度变化),溶液pH随通入(或加入)物质的物质的量的变化如图所示。下列叙述错误的是( )
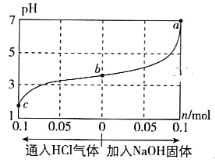
A. 水的电离程度:a>b>c
B. c点对应的混合溶液中:c(CH3COOH)>c(Na+)>c(OH-)
C. a点对应的混合溶液中:c(Na+)=c(CH3COO-)
D. 该温度下,CH3COOH的电离平衡常数
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.1.0mol/L的KNO3溶液:H+、Fe2+、Cl−、
B.甲基橙呈红色的溶液:
、Ba2+、
、Cl−
C.pH=12的溶液:K+、Na+、CH3COO−、Br−
D.使KSCN显血红色的溶液:
、Mg2+、I−、Cl−
难度: 中等查看答案及解析
-
在一定温度下,将气体0.22 mol X和气体0.16 mol Y充入5 L恒容密闭容器中,发生反应2X(g) + Y(g)
2Z(g) △H<0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min
2
4
7
9
n(Y)/mol
0.12
0.11
0.10
0.10
下列说法正确的是( )
A.该温度下此反应的平衡常数K = 72.0 L/mol
B.反应前2 min的平均速率υ(Z) = 4.0×10-3 mol/(L·min)
C.其他条件不变,降低温度,反应达到新平衡前υ(逆) > υ(正)
D.其他条件不变,再充入0.1 mo1 X,新平衡时X的转化率将增大
难度: 困难查看答案及解析
-
柠檬烯是一种食用香料,其结构简式为
,下列有关柠檬烯的分析正确的是( )
A.柠檬烯的一氯代物有7种
B.柠檬烯和丁基苯互为同分异构体
C.柠檬烯分子中所有的碳原子可能在同一平面上
D.在一定条件下,柠檬烯可以发生加成反应、取代反应、氧化反应及还原反应
难度: 中等查看答案及解析
-
下列事实能说明亚硫酸的酸性强于碳酸的是
A.饱和亚硫酸溶液的pH小于饱和碳酸溶液的pH
B.亚硫酸能使酸性高锰酸钾溶液褪色,而碳酸不能
C.同温下,等浓度的亚硫酸氢钠和碳酸氢钠溶液,碳酸氢钠溶液的碱性强
D.将过量二氧化硫气体通入碳酸氢钠溶液中,逸出的气体能使澄清石灰水变浑浊
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依次增大,X原子的最外层电子数是次外层的2倍,Y与W属于同一主族且W原子的核外电子数是Y原子的2倍,Z是短周期原子半径最大的元素。下列说法正确的是( )
A.原子半径:r(W)>r(Y)>r(X)
B.Z与Y形成的化合物是离子化合物
C.X的最高氧化物对应水化物的酸性比W的强
D.Y的简单气态氢化物的热稳定性比W的弱
难度: 简单查看答案及解析
-
NA表示阿伏加德罗常数的数值,下列说法正确的是
①3.9g苯与足量的H2反应时,参与反应的碳碳双键数为0.15NA
②3.1g氧化钠和3.9g过氧化钠的混合物中含有的阴离子总数为0.1NA
③1.8g14CH4和水蒸气(H216O)的混合气体中含电子数目为NA
④常温下1L0.5mol/LNH4Cl溶液与2L0.25mol/LNH4Cl溶液所含
的数目相同
⑤常温下4.6gNO2和N2O4,混合气体中所含原子总数为0.3NA
⑥1molSiO2晶体中含有极性共价键数目为2NA
⑦将1molCl2通入足量水中,溶液中HClO、Cl−、ClO−粒子数之和为2NA
⑧高温下,16.8gFe与足量水蒸气完全反应转移电子数为0.8NA
A.①②④⑥ B.②③⑤⑧ C.②③⑥⑦ D.③⑤⑦⑧
难度: 困难查看答案及解析
-
在浓盐酸中H3AsO3与SnCl2反应的离子方程式为3Sn2++2H3AsO3+6H++18Cl-
2As+3
+6M关于该反应的说法中正确的组合是
①氧化剂是H3AsO3
②还原性:As>SnCl2
③每生成1molAs,反应中转移电子的物质的量为3mol
④M为OH-
⑤
是氧化产物
A.①②④⑤ B.①③⑤ C.①②③④ D.只有①③
难度: 简单查看答案及解析
-
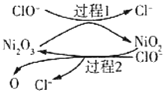
海水化学资源开发利用的部分过程如图所示,下列说法正确的是( )
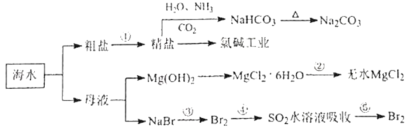
A.用澄清的石灰水可鉴别NaHCO3和Na2CO3
B.从海水中得到粗盐主要是通过蒸发操作实现的
C.在步骤③,中可通入Cl2使溴离子被还原为Br2
D.在步骤④中,SO2水溶液吸收Br2后,溶液的pH增大
难度: 简单查看答案及解析
-
下列说法正确的有几个
①pH=0的溶液中Fe3+与S2−因发生双水解而不共存
②MgCl2溶液蒸干后得MgO固体,如果想要得到MgCl2固体应通入HCl的气流
③将0.1mol的Na2CO3溶于水中,形成溶液中阴离子总数小于0.1NA
④已知:AgCl(s)⇌Ag+(aq)+Cl−(aq),加少量水稀释平衡右移,c(Ag+)减小.
⑤
和
在溶液中因为互相抑制水解而大量共存
⑥pH=2的盐酸和醋酸,均稀释到pH=5,醋酸加水量大
⑦NaHSO3溶液中加入少量NaOH固体,
将增大
A.2个 B.3个 C.4个 D.5个
难度: 困难查看答案及解析
-
下列关于化学反应方向及其判据的说法错误的是( )
A. 1mol H2O在不同状态时的熵值:S[H2O(s)]<S[H2O(g)]
B. 放热反应都可以自发进行,而吸热反应不能自发进行
C. 2KClO3(s)=2KCl(s)+3CO2(g)△H>0能否自发进行与温度有关
D. 常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0
难度: 简单查看答案及解析
-
常温下,向
的
溶液中滴加
的 NaOH溶液,所得溶液的pH与NaOH溶液体积的关系如图所示,下列说法正确的是
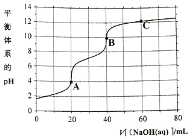
A.
溶液第一步滴定可用酚酞作指示剂
B.A点溶液中
C.图像中A、B、C三处溶液中
相等
D.B点溶液存在
难度: 中等查看答案及解析
-
常温时,1 mol/L的HClO2和,1 mol/L的HMnO4两种酸溶液,起始时的体积均为Vo,分别向两溶液中加水进行稀释,稀释后溶液体积为V,所得曲线如图所示。下列说法正确的是
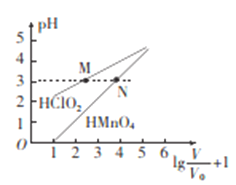
A.稀释前分别用1mol·L-1的NaOH溶液中和,消耗的NaOH溶液体积:HMnO4>HClO2
B.当稀释至pH均为3时,溶液中c(ClO2-)>c(MnO4-)
C.在0≤pH≤5时,HMnO4溶液满足,pH=
D.常温下,浓度均为0.1mol·L-1的NaClO2和NaMnO4溶液的pH: NaMnO4>NaClO2
难度: 困难查看答案及解析
-
已知:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(1) △H 1,
2CO(g)+O2(g)=2CO2(g) △H 2
2H2(g)+O2(g)=2H2O(1) △H 3;
2H2(g)+O2(g)=2H2O(g) △H 4
CO(g)+2H2(g)=CH3OH(g) △H 5
下列关于上述反应焓变的判断正确的是( )
A.△H 1<0,△H 2>0 B.0>△H 3>△H 4
C.2△H 5+△H 1>0 D.ΔH1=ΔH2+2ΔH3-2ΔH5
难度: 简单查看答案及解析
-
已知Ag2SO4的Ksp=c2(Ag+)×c(SO42-)=1.4×10-5,将适量Ag2SO4固体溶于100mL水中至刚好饱和,此时溶液中c(Ag+)=0.030mol·L-1。若t1时刻改变条件,下图中不正确的是( )
A.
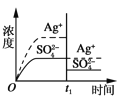 加入100mL蒸馏水
加入100mL蒸馏水B.
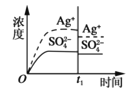 加入100mL0.010 mol·L-1AgSO4溶液
加入100mL0.010 mol·L-1AgSO4溶液C.
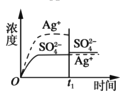 加入100mL0.020mol·L-1Na2SO4溶液
加入100mL0.020mol·L-1Na2SO4溶液D.
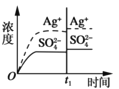 加入100mL0.040mol·L-1AgNO3溶液
加入100mL0.040mol·L-1AgNO3溶液难度: 中等查看答案及解析
-
某可充电电池的原理如图所示,已知a、b为惰性电极,溶液呈酸性。充电时右槽溶液颜色由绿色变为紫色。下列叙述正确的是
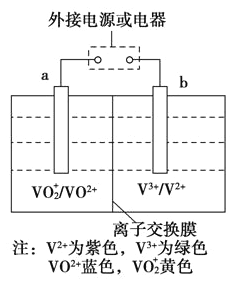
A.放电时,H+从左槽迁移进右槽
B.放电过程中,左槽溶液颜色由黄色变为蓝色
C.充电时,b极接直流电源正极,a极接直流电源负极
D.充电过程中,a极的电极反应式为:VO2++2H++e- = VO2++H2O
难度: 困难查看答案及解析
-
已知:
,
。298K时,
,
,
。在CuCl、CuBr、CuI的饱和溶液中阳离子和阴离子浓度关系如图所示。下列说法正确的是
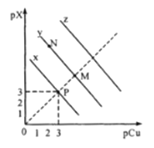
A.298K时,在CuCl的饱和溶液中加入少量NaCl,c(Cu+)和c(Cl-)都减小
B.图中x代表CuI曲线,且P点c(Cu+)=c(Cl-)
C.298K时增大M点的阴离子浓度,则y上的点向N点移动
D.298K时
的平衡常数K的数量级为103或102
难度: 中等查看答案及解析