-
下列事实不能用元素周期律解释的是
A. 碱性:NaOH>LiOH B. 热稳定性:Na2CO3>NaHCO3
C. 酸性:HClO4> H2SO4 D. 气态氢化物的稳定性:HBr > HI
难度: 中等查看答案及解析
-
a、b、c、d为短周期元素,a的原子中只有1个电子,b2−和C+离子的电子层结构相同,d与b同族。下列叙述错误的是
A.a与其他三种元素形成的二元化合物中其化合价均为+1
B.b与其他三种元素均可形成至少两种二元化合物
C.c的原子半径是这些元素中最大的
D.d和a形成的化合物的溶液呈弱酸性
难度: 中等查看答案及解析
-
已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是周期表中原子半径最小的元素,Y元素的最高正价与最低负价的绝对值相等,Z的核电荷数是Y的2倍,W的最外层电子数是其最内层电子数的3倍。下列说法不正确的是( )
A.原子半径:Z>W>R
B.对应的氢化物的热稳定性:R>W
C.W与X、W与Z形成的化合物的化学键类型完全相同
D.Y的最高价氧化物对应的水化物是弱酸
难度: 中等查看答案及解析
-
五种短周期元素的某些性质如表所示(其中只有W、Y、Z为同周期元素)。下列说法正确的是 ( )
元素代号
X
W
Y
Z
Q
原子半径(×10-12m)
37
64
66
70
154
主要化合价
+1
-1
-2
+5、-3
+1
A.由Q与Y形成的化合物中只存在离子键
B.Z与X之间形成的化合物具有还原性
C.由X、Y、Z三种元素形成的化合物的水溶液呈碱性
D.W的最高正价为+7
难度: 中等查看答案及解析
-
下列叙述正确的是
A.离子化合物中不可能含共价键
B.活泼金属与活泼非金属化合时能形成离子键
C.由非金属元素形成的化合物一定是共价化合物
D.共价化合物不可能含有离子键,熔融状态可以导电
难度: 简单查看答案及解析
-
应用元素周期律的有关知识,可以预测我们不熟悉的一些元素的单质及其化合物的性质,下列预测中正确的是
①第2周期非金属元素的气态氢化物溶于水后,水溶液可能为碱性
②砹(At)单质为有色固体,AgAt不溶于水,也不溶于稀硝酸
③Li在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱
④硫酸锶(SrSO4)是难溶于水的白色固体
⑤硒化氢(H2Se)是比H2S稳定的气体
A.②④ B.①②④ C.①③⑤ D.②④⑤
难度: 中等查看答案及解析
-
元素性质呈周期性变化根本原因是
A.核电荷数逐渐增大 B.元素的相对原子质量逐渐增大
C.核外电子排布呈周期性变化 D.元素的主要化合价呈周期性变化
难度: 中等查看答案及解析
-
下列各组中属于同位素的是
A.40K与40Ca B.35Cl2和37Cl2 C.D与T D.金刚石与石墨
难度: 简单查看答案及解析
-
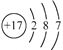
硒是人体必需的微量元素,图是硒在周期表中的信息,关于硒元素的说法错误的是

A. 位于第四周期
B. 质量数为34
C. 原子最外层有6个电子
D. 相对原子质量为78.96
难度: 中等查看答案及解析
-
用化学用语表示 NH3+ HCl
NH4Cl中的相关微粒,其中正确的是( )
A. 中子数为8的氮原子:
B. HCl 的电子式:
C. NH3的结构式:
D. Cl−的结构示意图:
难度: 简单查看答案及解析
-
下列关于元素周期表的说法错误的是( )
A.在整个18列元素中,第3列元素种类最多
B.同周期第IIA,第ⅢA的元素原子序数之差可能是1、11、25
C.在过渡元素中可以寻找催化剂,耐高温,耐腐蚀的合金材料
D.元素周期表中的过渡元素就是副族元素
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A.化学反应的实质是旧键的断裂,新键的生成
B.CH4、CF4、CCl4、CBr4熔沸点逐渐升高,原因是分子间作用力逐渐增大
C.NH3和H2O间可以形成氢键,这也是氨极易溶于水的原因之一
D.NH4H中含有离子键、极性键、非极性键
难度: 简单查看答案及解析
-
2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是
A.In是第五周期第ⅢA族元素
B.11549In的中子数与电子数的差值为17
C.原子半径:In>Al
D.碱性:In(OH)3>RbOH
难度: 中等查看答案及解析
-
已知短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
A. 原子半径:A>B>D>C B. 原子序数:d>c>b>a
C. 离子半径:C>D>B>A D. 单质的还原性:A>B>D>C
难度: 简单查看答案及解析
-
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图1所示。下列说法正确的是
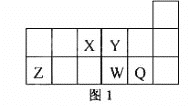
A.元素X与元素Z的最高正化合价之和的数值等于8
B.原子半径的大小顺序为:rX>rY>:rZ>rW>rQ
C.离子Y2-和Z 3+的核外电子数和电子层数都不相同
D.元素W的最高价氧化物对应的水化物的酸性比Q的强
难度: 中等查看答案及解析
-
某元素的一种同位素X 的质量数为A,含N个中子,它与1H 原子构成HmX分子。在agHmX中所含质子的物质的量是
A.
mol B.
(A-N)mol
C.
(A-N)mol D.
(A-N+m)mol
难度: 中等查看答案及解析