-
下列关于电解质溶液的叙述正确的是( )
A.常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为c(Cl-)>c(NH4+)>c(H+)=c(OH-)
B.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液为pH大
难度: 中等查看答案及解析
-
实验室用标准盐酸测定某NaOH溶液的浓度,用甲基橙作指示剂,下列对测定结果评价错误的是
选项
操作
测定结果评价
A
酸式滴定管在装液前未用标准盐酸润洗2~3次
偏高
B
开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
偏高
C
锥形瓶未干燥
无影响
D
盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
偏低
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列过程需要通电后才可以发生或进行的是
①电离 ②电泳 ③电解 ④电镀 ⑤电化学腐蚀
A.①② B.②③④ C.②③④⑤ D.全部
难度: 中等查看答案及解析
-
选用下列试剂和电极:稀H2SO4、Fe2(SO4)3溶液、Fe、Cu、Zn,组成如图所示的原电池装置(只有两个电极):观察到电流计G的指针均明显偏转,则其可能的组合共有

A.3种 B.4种 C.5种 D.6种
难度: 简单查看答案及解析
-
下列有关热化学方程式书写及对应表述均正确的是
A.密闭容器中,9.6g硫粉与11.2g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量。则Fe(s)+S(s)=FeS(s)△H=-95.6kJ/mol
B.稀醋酸与0.1 mol/LNaOH溶液反应:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol
C.已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式:2H2O(l)=2H2(g)+O2(g)△H=+285.5kJ/mol
D.已知2C(s)+O2(g)=2CO(g)△H=-221kJ/mol,则可知C的燃烧热△H=-110.5kJ/ mol
难度: 中等查看答案及解析
-
下列各组物质全部是弱电解质的是
A.H2O、NH3·H2O、H3PO4、HF B.Cu(OH)2、CH3COOH、C2H5OH、CH3COONa
C.H2SO3、Ba(OH)2、BaSO4 D.SO2、H2S、CO2
难度: 简单查看答案及解析
-
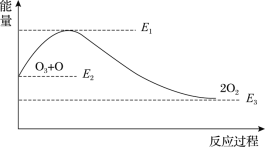
一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
SO2(g)+2CO(g)
2CO2(g)+S(l)△H<0 若反应在恒容的密闭容器中进行,下列有关说法正确的是
A.平衡前,随着反应的进行,容器内压强始终不变
B.平衡时,其他条件不变,分离出硫,正反应速率加快
C.平衡时,其他条件不变,升高温度可提高SO2的转化率
D.其他条件不变,使用不同催化剂,该反应平衡常数不变
难度: 简单查看答案及解析
-
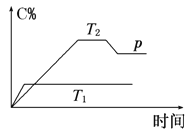
用CO合成甲醇的化学方程式为:CO(g)+2H2(g)⇌CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )

A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c) v(b)>v(d)
C.平衡常数:K(a)>K(c) K(b)=K(d)
D.平均摩尔质量M(a)<M(c) M(b)>M(d)
难度: 简单查看答案及解析
-
在已达到电离平衡的0.1 mol/L的醋酸溶液中,欲使平衡向电离的方向移动,同时使溶液的pH降低,应采取的措施是( )
A.加少量盐酸
B.加热
C.加少量醋酸钠晶体
D.加少量NaOH晶体
难度: 简单查看答案及解析
-
某学生欲完成2HCl+2Ag=2AgCl+H2↑反应,设计了下列四个实验,你认为可行的实验是
A.
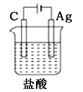 B.
B. C.
C. D.
D.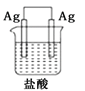
难度: 简单查看答案及解析
-
用如图装置进行实验(A为电流计):
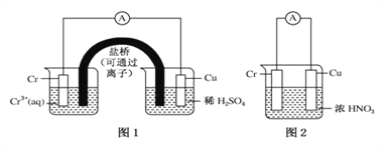
观察到现象:
装置图1:Cu电极上产生大量的无色气泡
装置图2:Cu电极上无气泡产生,而Cr电极上产生大量气泡
则下列说法正确的是
A. 图1是电解池,图2是原电池
B. 两个电池中,电子均由Cr电极流向Cu电极
C. 图2中Cr电极可能被浓HNO3钝化成惰性电极
D. 由实验现象可知金属活动性:Cu>Cr
难度: 中等查看答案及解析
-
常温下,用 0.1000 mol·L
NaOH溶液滴定 20.00mL0.1000 mol·L
溶液所得滴定曲线如图。下列说法正确的是
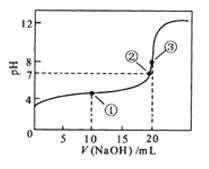
A.点①所示溶液中:
B.点②所示溶液中:
C.点③所示溶液中:
D.滴定过程中可能出现:
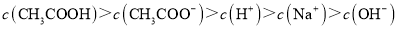
难度: 中等查看答案及解析