-
把下列4种X溶液,分别加入到4个盛有10mL2mol·L-1盐酸的烧杯中,并加水稀释到50mL,此时X与盐酸缓缓地进行反应,其中反应速率最大的是( )
A.20mL,3mol·L-1 B.20mL,2mol·L-1 C.10mL,4mol·L-1 D.10mL,2mol·L-1
难度: 简单查看答案及解析
-
下列叙述中,不正确的是 ( )
A.某特定反应的平衡常数仅是温度的函数
B.化学平衡发生移动,平衡常数必发生变化
C.其他条件一定时,平衡常数发生变化,化学平衡必定发生移动
D.催化剂不能改变平衡常数的大小
难度: 中等查看答案及解析
-
下列物质在水溶液中的电离方程式书写正确的是( )
A.CH3COOH=H++CH3COO- B.NaHSO4=Na++H++
C.H3PO4
3H++
D.NaHCO3
Na++H++
难度: 简单查看答案及解析
-
一定条件下,某容积不变的密闭容器内存在下列平衡:2HI(g)
H2(g)+I2(g);则下列有关说法正确的是
A.如改变体系温度,体系颜色不一定发生变化
B.如仅仅改变浓度这一条件,使得体系颜色加深,则上述平衡一定正移
C.继续充入HI气体,达到平衡后,体系颜色加深
D.温度不变时,当体系颜色变浅,则正反应速率和逆反应速率都将减小
难度: 中等查看答案及解析
-
已知氢气和碳燃烧的热化学方程式为:
①2H2(g)+O2(g)=2H2O(l) △H1=-akJ·mol-1
②H2(g)+1/2O2(g)=H2O(g) △H2=-bkJ·mol-1
③C(s)+1/2O2(g)=CO(g) △H3=-ckJ·mol-1
④C(s)+O2(g)=CO2(g) △H4=-dkJ·mol-1
下列说法错误的是
A.氢气的燃烧热为△H=-akJ·mol-1
B.c<d
C.一氧化碳的燃烧热为△H=-(d-c)kJ·mol-1
D.0.5a>b
难度: 简单查看答案及解析
-
室温下,向10 mL 0.1 mol/L醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中粒子的数目减小
B.再加入CH3COONa固体能促进醋酸的电离
C.醋酸的电离程度增大,c(H+)亦增大
D.溶液中
不变
难度: 简单查看答案及解析
-
高温下,某反应达到平衡,平衡常数K=
。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
A.该反应是焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应化学方程式为CO+H2O
CO2+H2
难度: 中等查看答案及解析
-
对于平衡体系:aA(g)+bB(g)⇌cC(g)+dD(g),正反应放热,有下列判断,其中正确的是
A.若温度不变,容器体积扩大一倍,此时A的浓度是原来的0.45倍,则a+b>c+d
B.若从正反应开始,平衡时A、B的转化率相等,则投入A、B物质的量之比为 a:b
C.若平衡体系中共有气体M mol,再向其中充入bmolB,达到平衡时气体总物质的量为(M+b)mol,则a+b>c+d
D.若a+b=c+d,则当容器内温度上升时,平衡向左移动,容器中气体的压强不变
难度: 中等查看答案及解析
-
对于可逆反应mA(g) + nB(g)
pC(g) + qD(g),若其它条件都不变,探究催化剂对反应的影响,可得到如下两种v-t图象。下列判断正确的是( )
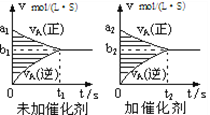
A.b1>b2 ,t1>t2
B.两图中阴影部分面积一定相等
C.A的平衡转化率(II)大于(Ⅰ)中A的转化率
D.若m+n<p+q,则压强变化对正反应速率的影响程度比逆反应速率影响程度大
难度: 中等查看答案及解析
-
向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应
达到平衡,正反应速率随时间变化的示意图如下所示。下列叙述正确的是( )
A.反应在c 点达到平衡状态
B.反应物浓度:
点小于
点
C.反应物的总能量低于生成物的总能量
D.
时,SO2的转化率:
段小于
段
难度: 中等查看答案及解析
-
加热N2O5依次发生的分解反应为:①N2O5(g)
N2O3(g)+O2(g) ②N2O3(g)
N2O(g)+O2(g),在容积为2 L的密闭容器中充入8 mol N2O5,加热到t ℃,达到平衡状态后O2为9 mol,N2O3为3.4 mol。则平衡体系中N2O5的物质的量浓度为( )
A.1.8mol/L B.0.9 mol/L C.2.3 mol/L D.4.0 mol/L
难度: 困难查看答案及解析
-
mA(g)+nB(g)
pC(g)的速率和平衡的影响图像如下,下列判断正确的是

A.由图1可知,T1<T2,该反应正反应为吸热反应
B.由图2可知,该反应m+n﹤p
C.图3中,表示反应速率v正>v逆的是点3
D.图4中,若m+n=p,则a曲线一定使用了催化剂
难度: 简单查看答案及解析
-
在一个温度恒定、容积固定的密闭容器中,发生可逆反应
mA(s)+nB(g)
pC(g)+qD(g),已知n=p+q,且该反应为放热反应,反应达到平衡的标志是( )
①体系的压强不再改变 ②气体的密度不再改变
③各气体的浓度不再改变 ④各气体的质量分数不再改变
⑤反应速率v(C)∶v(D)=p∶q
⑥单位时间内n mol B断键反应,同时p mol C也断键反应
A.②③④⑥ B.①②③④ C.①②③④⑥ D.④⑤⑥
难度: 简单查看答案及解析
-
一定条件下,CO2与H2O可以合成甲醇,反应的方程式为CO2(g)+2H2O(g)
CH3OH(g)+
O2(g),表示该反应的反应过程中的能量变化正确的是( )
A.
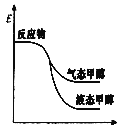 B.
B.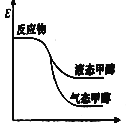 C.
C.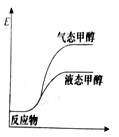 D.
D.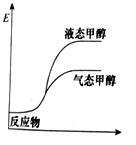
难度: 中等查看答案及解析
-
已知反应O2(g)+2Cl2(g)
2Cl2O(g) △H>0,在三个恒温、恒容的密闭容器中分别充人l mol O2与2mol Cl2,测得平衡时O2的转化率如下表.下列说法正确的是( )
容器编号
温度(℃)
容器体积/L
平衡时O2转化率
平衡时压强(Pa)
①
200
V1
50%
P1
②
200
V2
70%
P2
③
350
V3
50%
P3
A. 反应速率:③>①>②
B. 平衡时压强:P1>P2
C. 容器体积:V1<V3
D. 若实验②中O2和Cl2用量均加倍,则平衡时O2的转化率小于70%
难度: 简单查看答案及解析
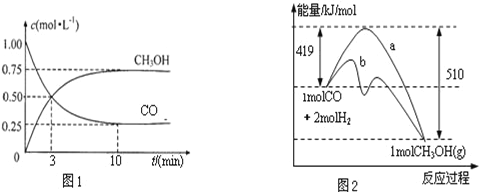
 增大的有__________;
增大的有__________;