-
为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后,再向滤液中加入适量的盐酸,这种试剂是( )
A.NH3·H2O B.NaOH C.MgCO3 D.Na2CO3
难度: 简单查看答案及解析
-
下列有关能量的判断和表示方法正确的是
A.由C(s,金刚石)=C(s,石墨) ΔH=-1.9kJ·mol-1,可知金刚石比石墨更稳定
B.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量比前者少
C.由H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1,可知:浓硫酸和氢氧化钠溶液充分混合生成1mol液态水时,放出的热量等于57.3kJ
D.2gH2(g)完全燃烧生成液态水放出285.8 kJ的热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l) ΔH=-285.8 kJ·mol-1
难度: 中等查看答案及解析
-
某科研小组公司开发了Li-SO2Cl2军用电池,其示意图如图所示,已知电池反应为:2Li+SO2Cl2=2LiCl+SO2↑。下列叙述中错误的是
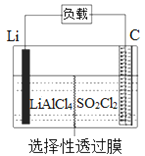
A. 电池工作时负极材料是Li,发生氧化反应
B. 将电解质溶液改为LiCl的水溶液,电池性能会更好
C. 电池工作时电子流向:锂电极→导线→负载→碳棒
D. 电池工作过程中,石墨电极反应式为SO2Cl2+2e−=2Cl−+SO2↑
难度: 困难查看答案及解析
-
肼(N2H4)是火箭发动机的燃料,它与N2O4反应生成氮气和水蒸气。已知:
①N2(g)+2O2(g)===N2O4(g)ΔH=+8.7 kJ·mol-1
②N2H4(g)+O2(g)===N2(g)+2H2O(g)ΔH=-534.0 kJ·mol-1
下列表示肼跟N2O4反应的热化学方程式正确的是
A.2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g) ΔH=-542.7 kJ·mol-1
B.2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g) ΔH=-1 076.7 kJ·mol-1
C.N2H4(g)+
N2O4(g)===
N2(g)+2H2O(g) ΔH=-1 076.7 kJ·mol-1
D.2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g) ΔH=-1 059.3 kJ·mol-1
难度: 简单查看答案及解析
-
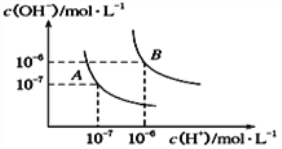
常温下,0.2mol/L的一元碱BOH与等浓度的HCl溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )

A.BOH 为强碱 B.该混合液pH=7
C.图中X表示BOH,Y表示H+,Z表示OH- D.该混合溶液中: c(Cl-)=c(Y)+c(B+)
难度: 中等查看答案及解析
-
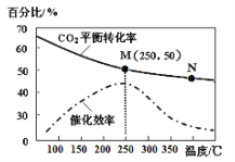
图中a曲线表示一定条件下可逆反应:X(g)+Y(g)
2Z(g)+W(s),△H<0的反应过程。若使a曲线变为b曲线,可采用的措施是:
A.升高温度 B.增大Y的浓度
C.降低温度 D.缩小体积
难度: 简单查看答案及解析
-
用氟硼酸(HBF4,属于强酸)代替硫酸作铅蓄电池的电解质溶液,可使铅蓄电池在低温下工作时的性能更优良,反应方程式为:Pb+PbO2+4HBF4
2Pb(BF4)2+2H2O,Pb(BF4)2为可溶于水的强电解质,下列说法正确的是
A. 放电时,负极反应为:PbO2+4HBF4-2e-=Pb(BF4)2+2BF4-+2H2O
B. 充电时,当正极质量减少23.9g时转移0.2mol电子
C. 放电时,PbO2电极附近溶液的pH增大
D. 充电时,Pb电极的电极反应式为PbO2+4H++2e-=Pb2++2H2O
难度: 中等查看答案及解析
-
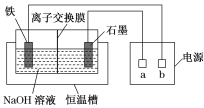
城市地下潮湿的土壤中常埋有纵横交错的管道和输电线路,当有电流泄漏并与金属管道形成回路时,就会引起金属管道的腐蚀。原理如图所示,但若电压等条件适宜,钢铁管道也可能减缓腐蚀,此现象被称为“阳极保护”。下列有关说法不正确的是
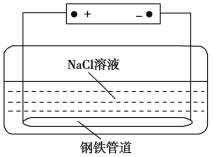
A.该装置能够将电能转化为化学能
B.管道右端腐蚀比左端快,右端电极反应式为Fe-2e-
Fe2+
C.如果没有外加电源,潮湿的土壤中的钢铁管道比较容易发生吸氧腐蚀
D.钢铁“阳极保护”的实质是在阳极金属表面形成一层耐腐蚀的钝化膜
难度: 中等查看答案及解析
-
常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示。下列说法中正确的是( )
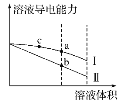
A.两溶液稀释前的浓度相同
B.a、b、c三点溶液的pH由大到小顺序为a>b>c
C.a点的Kw值比b点的Kw值大
D.a点水电离的c(H+)大于c点水电离的c(H+)
难度: 中等查看答案及解析
-
下列关于水溶液中的离子平衡问题叙述正确的是
A.将10mL0.1mol·L-1盐酸加入到10mL0.1mol·L-1碳酸钠溶液中:c(Na+)>c(Cl-)>c(HCO
)>c(CO
)
B.某温度下0.1mol·L-1的醋酸pH为3,加水稀释10倍,则稀释后的溶液pH等于4
C.0.02mol·L-1HCN溶液与0.02mol·L-1NaCN溶液等体积混合c(HCN)+c(CN-)=0.04mol·L-1
D.向0.01mol·L-1醋酸溶液中加水,稀释后溶液中
比值增大(忽略稀释过程中溶液温度变化)
难度: 中等查看答案及解析
-
25℃时,将0.1mol•L﹣1 NaOH溶液加入20mL0.1mol•L﹣1CH3COOH溶液中,所加入溶液的体积(V)和混合液的pH关系曲线如图所示。下列结论正确的是( )
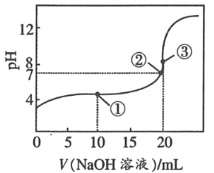
A.①点时,c(CH3COO﹣)+c(CH3COOH)=c(Na+)
B.对曲线上①②③任何一点,溶液中都有c(Na+)+c(H+)=c(OH﹣)+c(CH3COO﹣)
C.③点时,醋酸恰好完全反应完溶液中有c(CH3COO﹣)=c(Na+)>c(H+)=c(OH﹣)
D.滴定过程中可能出现c(H+)>c(Na+)>c(CH3COO﹣)>c(OH﹣)
难度: 中等查看答案及解析
-
已知H2A为二元弱酸,20℃时,配制一组c(H2A)+c(HA-)+c(A2-)=0.100mol/L的H2A和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列说法错误的是
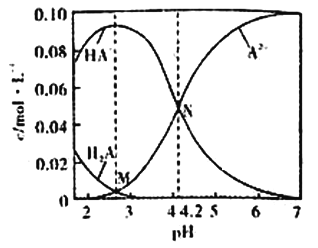
A.Ka2(H2A)的数量级为10-5
B.NaHA溶液中:c(H+)>c(OH-)
C.M点由水电离出的c(H+)>N点由水电离出的c(H+)
D.pH=7的溶液中:c(Na+)>2c(A2-)
难度: 困难查看答案及解析
-
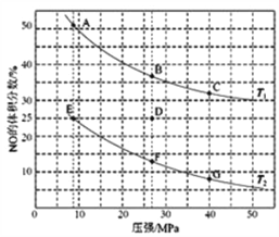
一定温度下,可用K2S沉淀Cu2+、Mn2+、Zn2+三种离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示。下列说法不正确的是( )
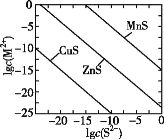
A.三种离子对应的硫化物的溶度积常数中,Ksp(MnS)最大,约为1×10-15;Ksp(CuS)最小,约为1×10-35
B.MnS+Cu2+
CuS+Mn2+,K=1020
C.向ZnS的悬浊液(含ZnS固体)中滴加少量水,沉淀溶解平衡向溶解的方向移动,c(S2-)不变
D.向Cu2+、Zn2+、Mn2+混合溶液中逐滴加入1×10-4mol·L-1的Na2S溶液,Cu2+最先沉淀
难度: 困难查看答案及解析