-
下列反应既是氧化还原反应,又是放热反应的是( )
A.Ba(OH)2·8H2O与NH4Cl的反应 B.铝与稀盐酸的反应
C.灼热的碳与二氧化碳的反应 D.氢氧化钠与盐酸的反应
难度: 简单查看答案及解析
-
下列各组元素性质的递变情况错误的是
A. Na、Mg、Al原子最外层电子数依次增多
B. P、S、Cl气态氢化物的稳定性依次增强
C. N、O、F最高价氧化物的水化物酸性依次增强
D. Na、K、Rb金属性依次增强
难度: 中等查看答案及解析
-
联合国大会确定2019年是“国际化学元素周期表年”。下列说法错误的是
A. 短周期共有18种元素
B. 元素周期表中有118种元素,即发现了118种原子
C. 在元素周期表金属与非金属的分界处可以找到半导体材料
D. 元素周期表中的每个周期都是按原子序数递增的顺序从左到右进行排列的
难度: 中等查看答案及解析
-
五种短周期元素的某些信息如下表所示,下列有关说法正确的是( )
元素
元素的相关信息
R
最高正价与最低负价的绝对值之和等于2
W
原子的M电子层上有3个电子
X
在短周期主族元素中,其原子半径最大
Y
原子的最外层电子数是电子层数的2倍,且低价氧化物能与其气态氢化物反应生成淡黄色单质
Z
最高价氧化物对应的水化物为一种强酸,可与其简单气态氢化物反应生成盐
A.W与Y、X与R形成的化合物都能与水反应,且都有气体生成
B.Z、X、W的简单离子半径依次增大
C.R与Y、Z分别形成的化合物水溶液均呈酸性
D.常温下X、Y、Z的最高价氧化物对应水化物的浓溶液都能与W的单质持续反应
难度: 中等查看答案及解析
-
根据下列短周期元素性质的数据判断,下列说法正确的是
①
②
③
④
⑤
⑥
⑦
⑧
原子半径/10-10m
0.66
1.36
1.23
1.10
0.99
1.54
0.70
1.24
最高价或最低价
-2
+2
+1
+5 -3
+7 -1
+1
+5 -3
+3
A.元素④⑤形成的化合物是离子化合物
B.元素⑦位于第二周期第Ⅴ族
C.元素①⑧形成的化合物具有两性
D.元素③的最高价氧化物对应水化物的碱性最强
难度: 中等查看答案及解析
-
下列物质中属于共价化合物的是
A.HCl B.Na2CO3 C.NaCl D.N2
难度: 简单查看答案及解析
-
某元素的离子结构示意图为
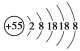 ,该元素在周期表中的位置是( )
,该元素在周期表中的位置是( )A. 第5周期零族 B. 第6周期第ⅠB族
C. 第5周期第ⅦA族 D. 第6周期第ⅠA族
难度: 简单查看答案及解析
-
2017年,我国科学家在利用镓(
Ga)进行肿瘤的早期精准诊断方面取得重大突破。下列关于
Ga的说法正确的是
A.质子数为31 B.中子数为68
C.质量数为99 D.核外电子数为37
难度: 简单查看答案及解析
-
干冰气化时,下列所述内容发生变化的是( )
A.分子内共价键 B.分子间作用力 C.分子的性质 D.分子间的氢键
难度: 简单查看答案及解析
-
下列物质中既含有非极性键,又含有离子键的是( )
A.MgBr2 B.H2O2 C.Na2O2 D.NH4Cl
难度: 简单查看答案及解析
-
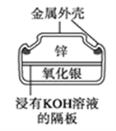
根据Zn+Cu2+=Zn2++Cu的反应原理所设计原电池装置,正确的是( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
已知反应:X+Y=M+N为放热反应,对该反应的下列说法中正确的是( )
A.X的能量一定高于M
B.Y的能量一定高于N
C.X和Y的总能量一定高于M和N的总能量
D.因为该反应为放热反应,故不必加热反应就可以发生
难度: 简单查看答案及解析
-
下列实验中,反应速率的加快是由催化剂引起的是( )
A. 在炭粉中加入氯酸钾,点燃时燃烧更为剧烈
B. 过氧化氢中加入少量二氧化锰,即可迅速放出气体
C. 固态氯化铁和固体氢氧化钠混合后,加入水能迅速产生沉淀
D. 锌与稀硫酸反应中加入少量硫酸铜溶液,反应放出氢气的速率加快
难度: 中等查看答案及解析
-
下列几种化学电池中,不属于可充电电池的是
A.碱性锌锰电池 B.手机用锂电池
C.汽车用铅蓄电池 D.玩具用镍氢电池
难度: 简单查看答案及解析
-
下列反应中,能量变化如图所示的是
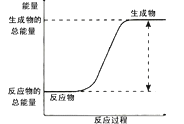
A. 碳酸钙受热分解 B. 乙醇在空气中燃烧
C. 铝粉与盐酸反应 D. 氧化钙溶解于水
难度: 中等查看答案及解析
-
根据下列信息判断氢气燃烧生成水时的热量变化,其中一定正确的是( )
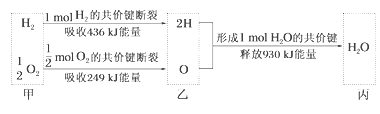
A.生成1molH2O时放出热量245kJ
B.H2O分解为H2与O2时放出热量
C.甲、乙、丙中物质所具有的总能量大小关系为甲>乙>丙
D.氢气和氧气的总能量小于水的能量
难度: 简单查看答案及解析
-
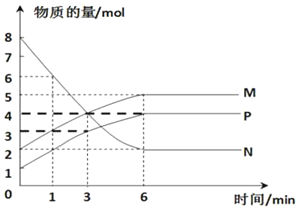
一定条件下,向2 L密闭容器中充入2 mol N2和10 mol H2发生反应N2+3H2
2NH3。2 min时测得剩余N2的物质的量为1 mol,下列有关化学反应速率的表达不正确的是
A. v(N2)=3 v(H2) B. v(H2)=0.75 mol·L-1·min-1
C. v(NH3)=0.5mol·L-1·min-1 D. 再充入2 mol N2化学反应速率加快
难度: 中等查看答案及解析
-
以下是反应A(g) + 3B(g) ⇌2C(g) + 2D(g) 在四种不同情况下的反应速率,反应速率最大的是
A.υ(A)=0.45mol·L-1·s-1 B.υ(B)=0.6mol·L-1·s-1
C.υ(C)=0.4mol·L-1·s-1 D.υ(D)=0.45mol·L-1·s-1
难度: 简单查看答案及解析
-
能够充分说明在恒温下的密闭容器中,反应2SO2+O2
2SO3已达平衡状态的标志是
A. 容器中SO2.O2.SO3的物质的量之比为2:1:2
B. SO2 和SO3的物质的量浓度相等
C. 单位时间内生成2molSO3 时,即消耗1molO2
D. 反应容器内压强不随时间变化而变化
难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,这四种元素的原子最外层电子数之和为21。下列说法不正确的是
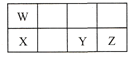
A.原子半径大小:X > Y > Z
B.W、Y两种元素都能与氧元素形成化合物WO2、YO2
C.氧化物对应水化物的酸性: Z > Y > W
D.Y能形成H2Y、H2YO4的化合物
难度: 中等查看答案及解析
-
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是
A. 最简单气态氢化物的热稳定性:R>Q
B. 最高价氧化物对应水化物的酸性:Q>W
C. 原子半径:T>Q>R
D. 单质T既可以与盐酸反应又能与NaOH溶液反应
难度: 中等查看答案及解析
-
钠和铯都是碱金属元素,下列关于铯及其化合物的叙述中正确的是
A. 铯的密度比水小,像钠一样浮在水面上
B. 铯与水反应十分剧烈,甚至会发生爆炸
C. 碳酸铯加热时易分解成二氧化碳和氧化铯
D. 氢氧化铯是强碱,其碱性比氢氧化钾弱
难度: 简单查看答案及解析
-
关于卤素(用X表示)的下列叙述正确的是
A. 卤族元素的最高价均为+7
B. HX都极易溶于水,它们的热稳定性随核电荷数增大而增强
C. 卤素单质从F2→I2颜色逐渐加深
D. 周期表中排在前面的卤素单质都可将排在后面的卤素从它的盐溶液里置换出来
难度: 简单查看答案及解析