-
下列叙述错误的是( )
A. 13C和14C属于同种元素,它们互为同位素
B. 1H和2H是不同的核素,它们的质子数相等
C. 14C和14N的质量数相等,它们的中子数不等
D. 6Li和7Li的电子数相等,中子数也相等
难度: 简单查看答案及解析
-
下列各组中每种物质都既有离子键又有共价键的一组是( )
A. NaOH H2SO4 (NH4)2SO4 B. MgO Na2SO4 HNO3
C. Na2O2 KOH Na3PO4 D. HCl Al2O3 MgCl2
难度: 简单查看答案及解析
-
元素性质呈周期性变化根本原因是( )
A.元素的相对原子质量逐渐增大
B.核外电子排布呈周期性变化
C.核电荷数逐渐增大
D.元素化合价呈周期性变化
难度: 简单查看答案及解析
-
X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法正确的是( )
X
Y
Z
W
A. X的气态氢化物比Y稳定
B. W的最高价氧化物的水化物的酸性比Z强
C. Z的非金属性比Y强
D. X与Y形成的化合物都易溶于水
难度: 困难查看答案及解析
-
2016年命名117元素Ts为钿(tián),根据元素周期律推测,下列说法错误的是
A.Ts 为金属元素 B.Ts 位于周期表的第七周期第VIIA 族
C.Ts 的主要化合价-1、+7 D.酸性: HClO4> HTsO4
难度: 简单查看答案及解析
-
下列说法正确的是
A.HCl的电子式为H:Cl
B.Na2O2只含有离子键
C.质量数为12的C原子符号为12C
D.用电子式表示KBr的形成过程:
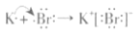
难度: 简单查看答案及解析
-
短周期元素X、Y、Z、W 的原子序数依次增大,X 原子最外层有6 个电子,Y 是至今发现非金属性最强的元素,Z 的周期序数等于族序数,W 与Z 相邻。下列说法不正确的是
A.可以电解Z的氯化物获得Z单质 B.Y 的氢化物可刻蚀玻璃
C.Z 的氧化物可用作耐火材料 D.W 的氧化物可用作光导纤维
难度: 简单查看答案及解析
-
如图所示,有关化学反应和能量变化的说法正确的是( )
a.
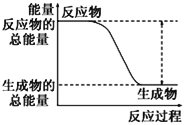 b.
b.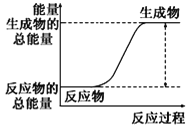
A.图a表示的是吸热反应的能量变化
B.图a不需要加热就能发生,图b一定需要加热才能发生
C.图a可以表示C与CO2反应生成CO的能量变化
D.图b中反应物比生成物稳定
难度: 简单查看答案及解析
-
共价键都有键能之说,键能是指拆开1mol共价键所需要吸收的能量。如H-H键的键能是436kJ/mol,H—Cl键的键能是431kJ/mol,Cl—Cl键的键能是247 kJ /mol,H2和Cl2反应生成1molHCl放出的热量是( )
A.431kJ B.179kJ C.89.5kJ D.以上说法都不对
难度: 简单查看答案及解析
-
有A、B、C、D四种金属,当A、B组成原电池时,电子流动方向A→B;当A、D组成原电池时,A为正极;B与C构成原电池时,电极反应式为:C2-+2e-→C,B-2e-→B2+则A、B、C、D金属性由强到弱的顺序为( )
A.A>B>C>D B.A>B>D>C
C.D>C>A>B D.D>A>B>C
难度: 简单查看答案及解析
-
在一定温度下,反应A2(g)+B2(g)
2AB(g)达到平衡的标志是( )
A.单位时间生成nmol的A2同时生成nmol的AB
B.容器内的压强不随时间变化
C.单位时间生成2nmol的AB同时生成nmol的B2
D.单位时间生成nmol的A2同时生成nmol的B2
难度: 简单查看答案及解析
-
下列图示变化为吸热反应的是
A.
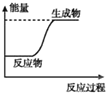
B.
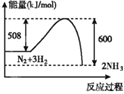
C.
D.
难度: 简单查看答案及解析
-
燃料电池是目前电池研究的热点之一。现有某课外小组自制的氢氧燃料电池,如图所示,a、b均为惰性电极。下列叙述不正确的是( )
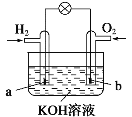
A.a极是负极,该电极上发生氧化反应
B.总反应方程式为2H2+O2═2H2O
C.b极反应是O2+4OH--4e-═2H2O
D.氢氧燃料电池是一种具有应用前景的绿色电源
难度: 简单查看答案及解析
-
在一定条件下,将3molA和1molB投入容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)
xC(g)+2D(g)。2min末测得此时容器中C和D的浓度为0.2mol/L和0.4mol/L。下列叙述正确的是 ( )
A.x=2
B.2min时,B的浓度为0.4mol/L
C.0~2min内B的反应速率为0.2mol·L-¹·min-¹
D.此时A的转化率为40%
难度: 简单查看答案及解析
-
由W、X、Y、Z四种金属按下列装置进行实验。下列说法不正确的是( )
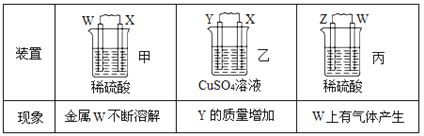
A.装置甲中W作原电池负极 B.装置乙中Y电极上的反应式为Cu2++2e−=Cu
C.装置丙中溶液的c(H+)不变 D.四种金属的活动性强弱顺序为Z>W>X>Y
难度: 中等查看答案及解析