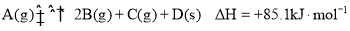-
化学与生产生活息息相关,下列有关说法正确的是( )
A.预防新冠病毒用95%的酒精比用75%的酒精效果好
B.淀粉、蛋白质、聚乙烯都属于天然高分子化合物
C.一束光通过气溶胶时会产生一条光亮的通路,这是胶体特有的现象
D.漂白粉、漂白液和漂粉精的有效成分都是次氯酸钙
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法不正确的是( )
A.28g乙烯和环丁烷的混合气体中含有的碳原子数为2NA
B.常温下,5.6gFe与含0.2molHNO3的溶液充分作用,最少失去的电子数为0.15NA
C.2.0gD2O中含有的质子数、电子数均为NA
D.含1molCl+的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液中NH
数为NA
难度: 中等查看答案及解析
-
下列实验操作对应的现象和结论均正确的是( )
选项
操作
现象
结论
A
相同温度下,测定等浓度的NaHCO3和NaHSO4溶液的pH
前者pH比后者大
非金属性:S>C
B
将相同体积、相同pH的盐酸和醋酸溶液分别稀释a、b倍
稀释后溶液pH相同
a>b
C
向25mL沸水中滴加5~6滴FeCl3饱和溶液,继续煮沸
生成红褐色沉淀
制得Fe(OH)3胶体
D
向H2O2溶液中滴加少量硫酸酸化的FeSO4溶液
溶液变为棕黄色后迅速出现大量气泡
Fe2+催化H2O2发生分解反应生成O2
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
1,
二异丙烯基苯是工业上常用的交联剂,可用于制备高性能超分子聚合物,其结构如图所示。下列有关1,
二异丙烯基苯的说法错误的是( )
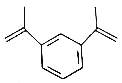
A.分子式为
B.能使溴水和高锰酸钾溶液褪色,但反应原理不同
C.分子中所有碳原子不可能处于同一平面
D.其一氯代物有5种
难度: 简单查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数逐渐增大,四种元素形成的化合物甲的结构如图所示。且W与X、Y、Z均可形成电子数相等的分子,
常温常压下为液体。下列说法不正确的是( )
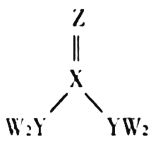
A.X、Y的简单氢化物的稳定性:
B.W、Y、Z三种元素不能形成离子化合物
C.
甲分子中存在
键
D.Y元素的简单氢化物能使湿润的红色石蕊试纸变蓝
难度: 中等查看答案及解析
-
我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:
,下列说法错误的是( )
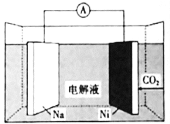
A.放电时,Na为电池的负极
B.充电时释放CO2,放电时吸收CO2
C.放电时,正极反应为:
D.充电时,阳极释放6.72L CO2时,转移的电子数为0.4NA
难度: 简单查看答案及解析
-
常温下,用AgNO3溶液分别滴定浓度均为0.01mol/L的KCl、
溶液,所得沉淀溶解平衡图像如图所示(不考虑
的水解)。下列叙述不正确的是( )
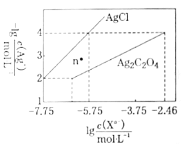
A.n点表示
的不饱和溶液
B.
的值等于10-9.75
C.
的平衡常数为109.04
D.向
的混合液中滴入AgNO3溶液时,先生成
沉淀
难度: 中等查看答案及解析
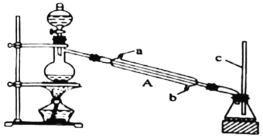
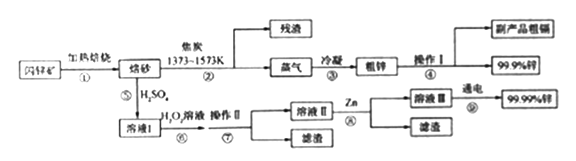
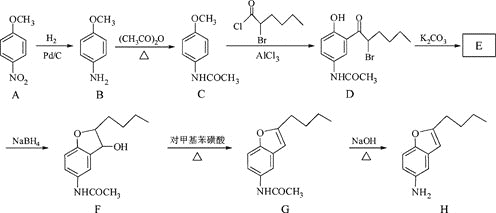
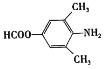 ,下列说法正确的是____________。
,下列说法正确的是____________。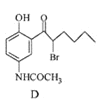 中手性碳原子(一个碳原子上连有4个不一样的原子或者原子团)个数为________。
中手性碳原子(一个碳原子上连有4个不一样的原子或者原子团)个数为________。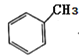
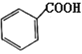
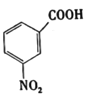
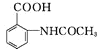 ,写出制备的合成路线流程图(无机试剂任选)。_________。
,写出制备的合成路线流程图(无机试剂任选)。_________。